Diferencia entre revisiones de «Átomo»
m (1 revisión importada) |
m (1 revisión importada) |
||
| (No se muestran 7 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
[[Category:Done 2020-12-31]] | [[Category:Done 2020-12-31]] | ||
[[en:Atom]] | [[en:Atom]] | ||
[[fr:Atome]] | |||
[[File:si_7x7.jpg|framed|thumb|right|x200px|Fig. 1. Una imagen de un microscopio de túnel de barrido<ref>Para una explicación de estos sorprendentes microscopios, consulte [http://hyperphysics.phy-astr.gsu.edu/hbasees/solids/piezo.html#c2 hyperphysics]</ref> de una superficie de [[:en:silicon|silicio]] especialmente preparada. Cada círculo naranja es un átomo individual.<ref>Downloaded from http://phys.org/news70293607.html</ref>]] | [[File:si_7x7.jpg|framed|thumb|right|x200px|Fig. 1. Una imagen de un microscopio de túnel de barrido<ref>Para una explicación de estos sorprendentes microscopios, consulte [http://hyperphysics.phy-astr.gsu.edu/hbasees/solids/piezo.html#c2 hyperphysics]</ref> de una superficie de [[:en:silicon|silicio]] especialmente preparada. Cada círculo naranja es un átomo individual.<ref>Downloaded from http://phys.org/news70293607.html</ref>]] | ||
<onlyinclude>Un '''átomo''' es la unidad más básica de un '''elemento'''. Todos los elementos tienen [[:en:periodic table of elements|propiedades distintas]] debido a la estructura de sus átomos. Por ejemplo, un átomo en la superficie de un cristal de silicio (véase Fig. 1) es diferente de los de la superficie de un cristal de [[uranio]]. La palabra "átomo" proviene de las raíces griegas 'a' (sin) y 'tom' (cortar).<ref>The Compact Oxford English dictionary pg 84, Oxford University Press, 2004.</ref> Hasta el siglo XX, se creía que los átomos eran la partícula más pequeña posible. | <onlyinclude>Un '''átomo''' es la unidad más básica de un '''elemento'''. Todos los elementos tienen [[:en:periodic table of elements|propiedades distintas]] debido a la estructura de sus átomos. Por ejemplo, un átomo en la superficie de un cristal de silicio (véase Fig. 1) es diferente de los de la superficie de un cristal de [[uranio]].</onlyinclude> La palabra "átomo" proviene de las raíces griegas 'a' (sin) y 'tom' (cortar).<ref>The Compact Oxford English dictionary pg 84, Oxford University Press, 2004.</ref> Hasta el siglo XX, se creía que los átomos eran la partícula más pequeña posible. | ||
==Composición== | ==Composición== | ||
| Línea 41: | Línea 42: | ||
Para obtener más información sobre los átomos, consulte la [http://chemwiki.ucdavis.edu/Physical_Chemistry/Atomic_Theory/The_Atom wiki de química de UC Davis]. | Para obtener más información sobre los átomos, consulte la [http://chemwiki.ucdavis.edu/Physical_Chemistry/Atomic_Theory/The_Atom wiki de química de UC Davis]. | ||
==Ver | ==Ver lecturas adicionales== | ||
*[[Hidrógeno]] | *[[Hidrógeno]] | ||
*[[Carbono]] | *[[Carbono]] | ||
Revisión actual - 15:58 9 nov 2021
Un átomo es la unidad más básica de un elemento. Todos los elementos tienen propiedades distintas debido a la estructura de sus átomos. Por ejemplo, un átomo en la superficie de un cristal de silicio (véase Fig. 1) es diferente de los de la superficie de un cristal de uranio. La palabra "átomo" proviene de las raíces griegas 'a' (sin) y 'tom' (cortar).[3] Hasta el siglo XX, se creía que los átomos eran la partícula más pequeña posible.
Composición

El núcleo es el componente central y muy denso de un átomo (véase Fig. 2). Está compuesto por protones y neutrones (denominados colectivamente nucleones) y es responsable de la gran mayoría de la masa atómica. Los protones y neutrones se mantienen unidos en el núcleo mediante lo que se llama la fuerza nuclear fuerte (que es la fuerza más fuerte conocida en el universo). Rodeando el núcleo hay una nube de electrones, que son mucho más pequeños y ligeros que los nucleones, y son atraídos al núcleo por la fuerza electromagnética al interactuar con los protones. Diferentes cantidades de protones, neutrones y electrones hacen que el átomo tenga diferentes propiedades químicas, lo que determina qué elemento es ese átomo.
Los átomos son inimaginablemente pequeños, y sus núcleos son 1000 veces más pequeños. De hecho, un centímetro cúbico del silicio que se ve en la Fig. 1 contiene aproximadamente 5 x 1022 átomos (¡eso es 5 con 22 ceros después!). Consulte la escala del universo para ver una representación visual de lo pequeños son los átomos.
Identificando el átomo
Protones
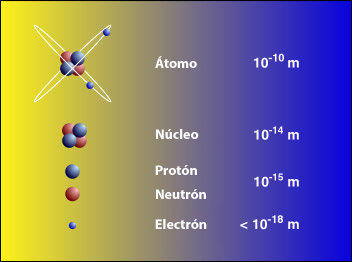
Un elemento es identificable por el número de protones que se encuentran dentro del núcleo de uno de sus átomos (véase Fig. 3). Además, el número de protones en el átomo también determina la ubicación del elemento en la tabla periódica de elemetos. Por ejemplo, un átomo de carbono tiene exactamente 6 protones en su núcleo y, por lo tanto, es el elemento número 6 en la tabla periódica. El torio tiene exactamente 90 protones y, por lo tanto, es el número 90 en la tabla periódica de elementos.
Electrones
Los átomos tienen el mismo número de protones y electrones. Sin embargo, un átomo puede perder o ganar uno o más electrones, volviéndose "desequilibrado". Un átomo desequilibrado se llama ion. Si gana un electrón (teniendo así más electrones que protones) se convierte en un ion con carga negativa o anión. Si ocurre lo contrario y el átomo pierde un electrón, se convierte en un ion con carga positiva o catión. Los iones pueden unirse fácilmente a otros iones, creando una gran variedad de compuestos diferentes.
Una forma en que los átomos ganan o pierden electrones es con la radiación de alta energía. Esta radiación hace que se formen iones y, como resultado, se denomina radiación ionizante.
Neutrones
Los neutrones tienen la misma masa que los protones, por lo que es muy fácil determinar cuántos hay dentro del núcleo de un átomo. Basta con restar el número de protones a la masa atómica del átomo para obtener el número de neutrones. Por ejemplo, el cesio es el número 55 en la tabla periódica de elementos y por lo tanto tiene 55 protones. Además, se sabe que su masa atómica (que también se encuentra en la tabla periódica) es de 133 u (unidades de masa atómica). Si se resta 55 de 133, se obtiene 78, que es el número de neutrones del átomo. El mismo tipo de átomo (determinado por el número de protones) puede tener diferentes números de neutrones.
Los átomos del mismo elemento con diferente número de neutrones se denominan diferentes "isótopos" del átomo. Por ejemplo, el carbono-12 (12C) es un isótopo del carbono, con 6 neutrones y el carbono-14 (14C) es otro isótopo del carbono, con 8 neutrones. Esto se discute más en la página sobre el núcleo.
Conociendo Nuclear
El equipo de Energy Education ha creado un video en la sección de Knowing Nuclear, inglés para Conociendo Nuclear, sobre esto.
Consulte el GIF de al lado para ver cómo traducir los subtítulos de YouTube.
PhET: Construye un Átomo
A continuación se muestra una simulación PhET interactiva de la Universidad de Colorado. Esta simulación crea un átomo a partir de protones, neutrones y electrones y prueba sus habilidades con la tabla periódica.
Para obtener más información sobre los átomos, consulte la wiki de química de UC Davis.
Ver lecturas adicionales
- Hidrógeno
- Carbono
- Oxígeno
- Uranio
- Dióxido de carbono
- Químico
- Mol
- O explore una página al azar
Referencias
- ↑ Para una explicación de estos sorprendentes microscopios, consulte hyperphysics
- ↑ Downloaded from http://phys.org/news70293607.html
- ↑ The Compact Oxford English dictionary pg 84, Oxford University Press, 2004.
- ↑ "The electron cloud" internet: http://letstalkaboutscience.wordpress.com/2012/02/16/the-electron-cloud/
- ↑ "Nature of the Universe: Chapter Eleven" internet: http://www.lcsd.gov.hk/CE/Museum/Space/EducationResource/Universe/framed_e/lecture/ch11/ch11.html
- ↑ Creado internamente por un miembro del equipo de Energy Education.


