Diferencia entre revisiones de «Batería»
energy_spanish>Luisa Sin resumen de edición |
m (1 revisión importada) |
(Sin diferencias)
| |
Revisión del 18:41 24 ago 2021

Una batería es un dispositivo que almacena energía y luego la descarga convirtiendo la energía química en electricidad. Las baterías típicas suelen producir electricidad por medios químicos mediante el uso de una o más celdas electroquímicas.[2] Se pueden utilizar y se han utilizado muchos materiales diferentes en las baterías, pero los tipos de baterías más comunes son las alcalinas, las de iones de litio, las de polímero de litio y las de hidruro metálico de níquel. Las baterías pueden conectarse entre sí en un circuito en serie o en paralelo.
Hay una gran variedad de baterías que se pueden comprar, y estos diferentes tipos de baterías se utilizan en diferentes dispositivos. Las baterías grandes se utilizan para arrancar vehículos, mientras que otras mucho más pequeñas pueden proporcionar energía a los audífonos. En general, las baterías son muy importantes en la vida cotidiana.
Celdas
Una celda es una unidad que produce electricidad mediante algún método. En general, las celda generan potencia a través de un proceso térmico, químico u óptico.
Una celda típica tiene dos terminales (denominados electrodos) sumergidos en una sustancia química (denominada electrolito). Los dos electrodos están separados por una pared porosa o puente que permite que la carga eléctrica pase de un lado a otro a través del electrolito. El ánodo, la terminal negativa, gana electrones y el cátodo, la terminal positiva, los pierde. Este intercambio de electrones permite que se desarrolle una diferencia de potencial o de voltaje entre las dos terminales, lo que permite que fluya la electricidad.[2]
Puede haber un gran número de celdas en una batería, desde una sola celda en una batería AA, hasta más de 7,100 celdas en la batería del Tesla Model S de 85 kWh.[3]
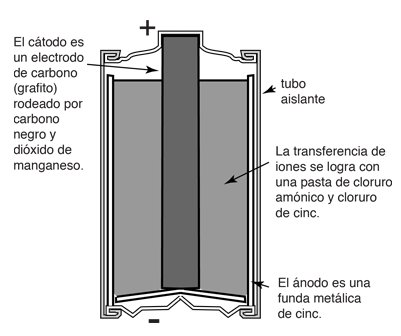
Celdas primarias ("secas")
En estas celdas, una acción química entre los electrodos y el electrolito provoca un cambio permanente, lo que significa que no son recargables.[2] Estas baterías son de un solo uso, lo que da lugar a más residuos por el uso de estas baterías, ya que se desechan después de un período de tiempo relativamente corto.
Celdas secundarias ("húmedas")
Este tipo de batería (denominada húmeda debido a que utiliza un electrolito líquido) genera una corriente a través de una celdas secundaria en la dirección opuesta a la celda primera o normal. Esto hace que la acción química vaya en sentido contrario, restaurándose de forma efectiva, lo que significa que son recargables.[2] Estas baterías pueden ser más caras de adquirir, pero generan menos residuos al poder utilizarse varias veces.
Capacidad de la Batería
Las baterías suelen clasificarse en función de su voltaje de salida y su capacidad. La capacidad es la duración de una batería en Ah (amperios hora)[2]:
Las baterías también pueden clasificarse por su capacidad energética. Esto se hace en vatios-hora o en kilovatios-hora.
Simulación de PhET
La Universidad de Colorado ha permitido amablemente el uso de la siguiente simulación de PhET. Esta simulación explora cómo funcionan las baterías en un circuito eléctrico:
Ver Lecturas Adicionales
Para más información, consulte las páginas relacionadas a continuación:
- Circuito en serie
- Circuito paralelo
- Corriente continua
- Fuente de energía eléctrica
- Red eléctrica
- Generador eléctrico
- O explore una página al azar
Referencias
- ↑ Wikimedia Commons [Online], Available: https://commons.wikimedia.org/wiki/File:Duracell_9_Volt_0849.jpg#/media/File:Duracell_9_Volt_0849.jpg
- ↑ 2,0 2,1 2,2 2,3 2,4 R.T. Paynter, “Basic Electric Components and Meters,” in Introduction to Electricity, 1rst ed. NJ: Prentice-Hall, 2011, ch. 3, sec. 3.4, pp. 89-94.
- ↑ Technology Metals Research. (Accessed July 28, 2015). Going Natural: The Solution To Tesla’s Graphite Problem [Online], Available: http://www.techmetalsresearch.com/2014/03/going-natural-the-solution-to-teslas-graphite-problem/
- ↑ Hyperphysics. (Accedido el 28 de julio de 2015). Baterías Carbono-Zinc [Online], Disponible: http://hyperphysics.phy-astr.gsu.edu/hbasees/electric/battery.html

