Carbono
El carbono (C) es el 6to elemento de la tabla periódica y también resulta ser el sexto elemento más abundante del universo.[2] El carbono es único debido a sus cuatro electrones de valencia que lo hacen muy versátil y le permiten unirse con muchos otros elementos, incluido él mismo. Hay más de 10 millones de compuestos conocidos que contienen carbono.[3]
El carbono y sus diferentes compuestos juegan un papel importante en el mundo en el que vivimos. Su importancia es tan grande hasta el punto que cuando se une a sí mismo forma diamantes, grafito y otras formas de carbono. El carbono en sí mismo no es necesariamente un problema, sin embargo, cuando so combina con otras moléculas es cuando comienzan a suceder cosas interesantes. Aunque hay más de 10 millones de compuestos de carbono, la ciencia de la energía se preocupa principalmente por unos pocos:
- Dióxido de carbono (CO2) y
- los abundantes hidrocarburos
Los hidrocarburos y el CO2 están estrechamente relacionados, como se analizará en la siguiente sección.
El carbono en combustibles
Los hidrocarburos son moléculas que contienen carbono e hidrógeno, forman los combustibles que el mundo usa para obtener la mayor parte de su energía primaria (alrededor del 95%[4]), y cuando los usamos para obtener esta energía, uno de los productos que se crea es el CO2. Los hidrocarburos son el componente principal de los combustibles fósiles, específicamente el gas natural, el petróleo y el carbón, de donde proviene una gran cantidad de energía mundial. Los combustibles fósiles proporcionan la mayor parte de la electricidad del mundo, además de proporcionar, los combustibles de transporte más utilizados, como la gasolina y el diésel.
Mediante el proceso de combustión de hidrocarburos se recupera la energía de los combustibles fósiles. Un hidrocarburo reacciona con oxígeno molecular, produciendo dióxido de carbono y vapor de agua, como se ve en la Fig. 2. Los diferentes tipos de hidrocarburos producen diferentes cantidades de dióxido de carbono, y los que se encuentran en el carbón mineral son los que más producen.[5]
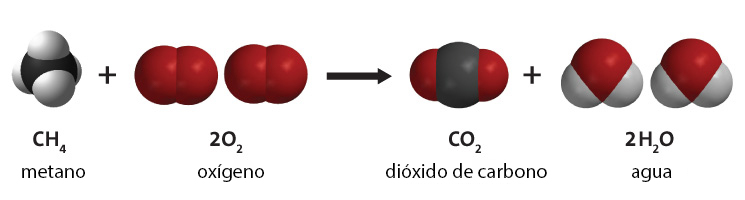
El carbono en la atmósfera
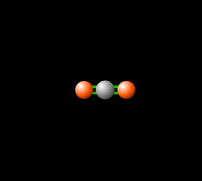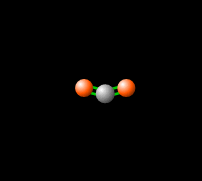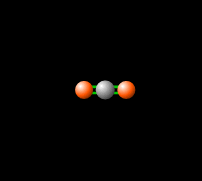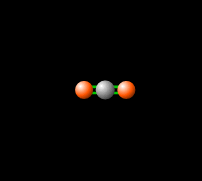
La combustión de hidrocarburos produce dióxido de carbono, un gas de efecto invernadero, lo que significa que absorbe y re-emite la radiación infrarroja de vuelta a la Tierra como se ve en la Fig. 3, produciendo un efecto de cambio climático. Aunque los gases de efecto invernadero son necesarios para las temperaturas habitables en la Tierra (haga clic aquí para obtener más información), el aumento de estos gases en la atmósfera contribuye al calentamiento global. El control de las emisiones de CO2 resultantes de la combustión de combustibles fósiles es una preocupación tecnológica, económica y política central.[8]
El metano (CH4), el monóxido de carbono y el carbono negro están presentes en la atmósfera y cada uno tiene efectos variables en el planeta. La cantidad de cada uno de estos en la atmósfera ha aumentado rápidamente. La cantidad de dióxido de carbono en la atmósfera ha aumentado aproximadamente un 35% y el metano en aproximadamente un 250%, desde la era industrial. Antes de la era industrial, estos niveles se habían mantenido relativamente estables durante unos 10 mil años.[9] El efecto de forzamiento climático del metano es aproximadamente 1/3 del del dióxido de carbono, por lo que se considera el segundo gas de efecto invernadero más importante. Se sabe que este aumento se debe a las actividades humanas, principalmente la combustión de combustibles fósiles y la tala de bosques.[10]
Ciclo natural del carbono
Tanto el dióxido de carbono como el metano, junto con todas las demás formas, son partes naturales del ciclo del carbono, el que contiene todas las formas de carbono del planeta que se encuentran en cualquier lugar, desde el océano hasta las capas superiores de la atmósfera.
El ciclo natural del carbono se mantiene casi en equilibrio; los animales y las plantas emiten CO2 a la atmósfera a través de la respiración, mientras que las plantas lo absorben mediante la fotosíntesis. Los océanos también reciclan el CO2 con la atmósfera, en un equilibrio casi perfecto. Este reciclado ocurre rápidamente, ya que una molécula típica de CO2 permanece sólo unos 5 años en la atmósfera.[11]
El efecto humano sobre el ciclo del carbono
Los seres humanos están afectando este ciclo natural, principalmente por la quema de combustibles fósiles, la fabricación de cemento y la eliminación de la silvicultura, como se ve en rojo en la Fig. 4 a continuación. El resultado es un aumento neto de carbono en la atmósfera y los océanos, lo que causa el efecto de calentamiento junto con la acidificación del océano.
Los efectos de ambos pueden tener efectos desastrosos en el ciclo del carbono, ya que pueden amplificar los efectos del carbono añadido en la atmósfera. Por ejemplo, los incendios forestales causados por los efectos del calentamiento global podrían liberar a la atmósfera gran parte del CO2 que se espera que sea eliminado por la vida vegetal. La acidificación de los océanos por el exceso de CO2 absorbido puede dañar la vida marina la que desempeña un papel importante en el ciclo del carbono oceánico.[11]
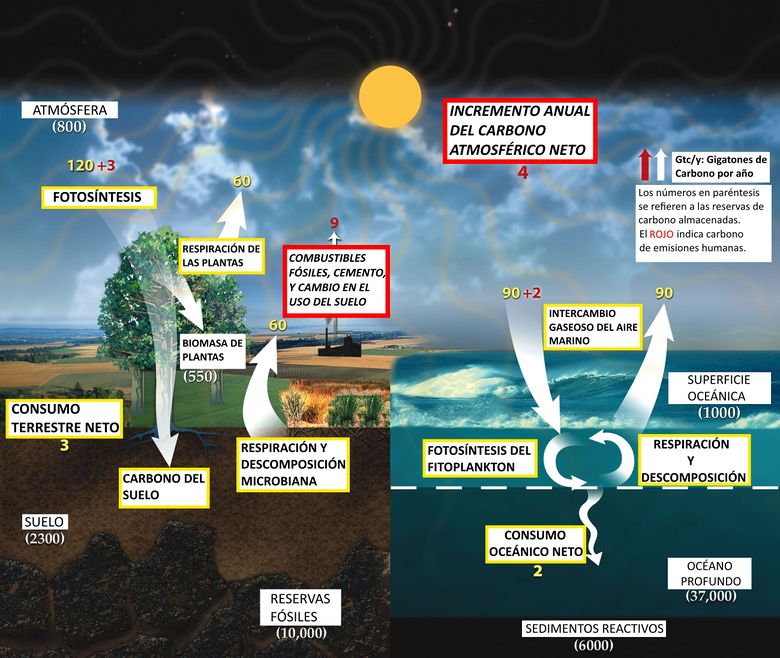
Destino del carbono en la atmósfera
Se mencionó anteriormente que una molécula típica de dióxido de carbono solo permanecerá en la atmósfera durante unos 5 años. Esto parece prometedor, sin embargo, no cuenta la historia completa. Si el efecto de la humanidad sobre el ciclo del carbono se detuviera instantáneamente, la mitad del carbono liberado a la atmósfera tardaría unos 100 años en ser hundido a las profundidades del océano o en la tierra. Sin embargo, a medida que hay cada vez menos carbono emitido por el hombre en el ciclo, el ciclo comienza a tardar más en deshacerse de él. Solo después de miles de años este carbono se eliminará casi por completo y, en ese momento, es posible que ya sea demasiado tarde para revertir sus efectos.[11]
Video
El siguiente video corresponde a un proyecto llamado "Periodic Videos" de la Universidad de Nottingham.[14] Ellos han creado un conjunto completo de videos cortos sobre cada elemento de la tabla periódica de elementos.
Consulte el GIF de al lado para ver cómo traducir los subtítulos de YouTube.
Ver lecturas adicionales
- Captura y almacenamiento de carbono
- Cultivo de carbono
- Emisiones de carbono antropogénicas
- C vs CO2
- O explore una página al azar
Referencias
- ↑ Hecha por un miembro del equipo de Energy Education.
- ↑ Jefferson Lab, 10 Most Abundant Elements in the Universe [Online], Available: http://education.jlab.org/glossary/abund_uni.html
- ↑ Los Alamos National Laboratory, Carbon [Online], Available: http://web.archive.org/web/20080913063402/http://periodic.lanl.gov/elements/6.html
- ↑ Datos de la OCDE, visite energía primaria para obtener más detalles.
- ↑ R.D. Botts, D.M. Carson, and D.Coglon. "Petroleum in our live" in Our petroleum challenge, 8th ed. Calgary:Canadian Center for Energy Development, 2013, pp. 7-15.
- ↑ American Chemical Society. "Methane and oxygen react". Internet: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson1, [October 25,2013]
- ↑ PhET Simulations, Moléculas y luz [Online], Disponible: https://phet.colorado.edu/es/simulation/molecules-and-light
- ↑ The Encyclopedia of Earth, Carbon [Online], Available: http://www.eoearth.org/view/article/150918/
- ↑ IPCC, The Natural Carbon Cycle [Online], Available: https://www.ipcc.ch/publications_and_data/ar4/wg1/en/ch7s7-3.html
- ↑ IPCC, FAQ: ¿Qué factores determinan el clima de la Tierra? [Online], Disponible: https://archive.ipcc.ch/publications_and_data/ar4/wg1/es/faq-1-1.html
- ↑ 11,0 11,1 11,2 R. Wolfson, "Carbon: A Closer Look" in Energy, Environment, and Climate, 2nd ed., New York, NY: W.W. Norton & Company, 2012, ch. 13, sec. 5, pp. 357-361
- ↑ Wikimedia Commons [Online]. (January 5 2021). Disponible: https://commons.wikimedia.org/wiki/File:ESPA%C3%91OL_Carbon_cycle.jpg
- ↑ Creado internamente por un miembro del equipo de Energy Education.
- ↑ See more videos from the University of Nottingham on different elements here: http://www.periodicvideos.com/


