Diferencia entre revisiones de «Combustión de hidrocarburos»
energy_spanish>Luisa ("Ver lecturas adicionales" follows Spanish capitalization rules) |
m (1 revisión importada) |
(Sin diferencias)
| |
Revisión actual - 15:59 9 nov 2021
La combustión de hidrocarburos se refiere a la reacción química en la que un hidrocarburo reacciona con oxígeno para crear dióxido de carbono, agua y calor. Los hidrocarburos son moléculas que constan de hidrógeno y carbono. Son más famosos por ser el componente principal de los combustibles fósiles, es decir, el gas natural, el petróleo y el carbón. Por esta razón, los recursos de combustibles fósiles a menudo se denominan recursos de hidrocarburos.[1] La energía se obtiene de los combustibles fósiles mediante la combustión (quema) del combustible. Aunque existen impurezas en los combustibles fósiles, la combustión de hidrocarburos es el proceso principal en la quema de estos combustibles. En la Fig. 1 se ilustra un ejemplo de combustión de hidrocarburos. Consulte la simulación en la parte inferior de la página para ver más ejemplos.
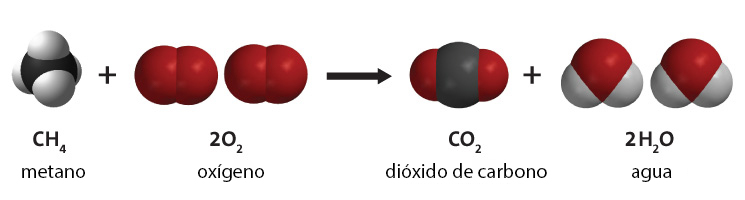
Descripción
Independientemente del tipo de hidrocarburo, la combustión con oxígeno produce 3 productos: dióxido de carbono, agua y calor, como se muestra en la reacción general a continuación. La energía necesaria para romper los enlaces en las moléculas de hidrocarburos es sustancialmente menor que la energía liberada en la formación de enlaces en las moléculas de CO2 y H2O. Por esta razón, el proceso libera cantidades importantes de energía térmica (calor). Esta energía térmica se puede usar directamente (quizás para calentar una casa) o se puede convertir en energía mecánica, usando un motor térmico. Sin embargo, esto está sujeto a pérdidas de eficiencia, lo que resulta en pérdidas de energía necesariamente significativas (como calor residual) regidas por la segunda ley de la termodinámica. La energía mecánica útil resultante será mucho menor que la energía térmica inicial proporcionada por la combustión de hidrocarburos.
Ecuación de Reacción General:
- [math]\displaystyle{ x }[/math] se refiere al número de átomos de carbono en el hidrocarburo
- [math]\displaystyle{ y }[/math] se refiere al número de átomos de hidrógeno en el hidrocarburo
- [math]\displaystyle{ N }[/math] se refiere al número de átomos de oxígeno necesarios en la reacción de combustión de hidrocarburos
Combustión de Hidrocarburos y Combustibles Fósiles
Tenga en cuenta que el CO2 siempre se produce en la combustión de hidrocarburos; no importa el tipo de molécula de hidrocarburo. Durante la producción de CO2 y H2O es cuando se obtiene la energía útil de los combustibles fósiles. Por esta razón, es importante distinguir entre el dióxido de carbono y otros productos "de desecho" que surgen de las impurezas en el combustible, como los compuestos de azufre y nitrógeno.[1] Los desechos que surgen de las impurezas se pueden eliminar con la tecnología adecuada; el CO2 no se puede eliminar a menos que los combustibles fósiles no se quemen (utilicen) en primer lugar.
No todos los combustibles fósiles tienen la misma composición. El gas natural está compuesto por más del 90% de metano (CH4), que es la molécula de hidrocarburo más pequeña. El petróleo tiende a estar compuesto por moléculas de tamaño mediano, aunque la composición varía mucho de un grado de crudo a otro. En general, cuanto más denso es el aceite, más largas son las cadenas de carbono en las moléculas. Finalmente, el carbón contiene las moléculas de hidrocarburos más grandes y complejas.[1]
Dado que los diferentes hidrocarburos tienen diferentes contenidos de hidrógeno a carbono, producen diferentes proporciones de agua a dióxido de carbono. En general, cuanto más larga y compleja es la molécula, mayor es la relacion de carbono a hidrógeno. Por esta razón, la combustión de cantidades iguales de diferentes hidrocarburos producirá diferentes cantidades de dióxido de carbono, dependiendo de la proporción de carbono a hidrógeno en las moléculas de cada hidrocarburo. Dado que el carbón contiene las moléculas de hidrocarburos más largas y complejas, la quema de carbón libera más CO2 que la quema de la misma masa de petróleo o gas natural. Esto depende de la densidad energética de cada uno de estos combustibles.
Emisiones de dióxido de carbono
A continuación se muestra un gráfico del CO2 emitido por la producción de 293.1 kWh (1,000,000 BTUs) de energía a partir de varios combustibles de hidrocarburos.[3]
| Combustible | kg de emisiones de CO2 |
|---|---|
| Carbón de antracita | 104 |
| Carbón bituminoso | 93.5 |
| Carbón de lignito | 97.9 |
| Carbón subbituminoso | 97.4 |
| Diésel | 73.2 |
| Gasolina | 71.5 |
| Propano | 63.2 |
| Gas natural | 53.2 |
Animación de Combustión
Elija un combustible del menú desplegable para ver la reacción neta que ocurre durante la combustión.
Ver lecturas adicionales
Para obtener más información, consulte las páginas relacionadas a continuación:
- Combustible fósil
- Energía primaria
- Recurso de hidrocarburos
- Carbón
- Petróleo
- Gas natural
- O explore una página al azar
Referencias
- ↑ 1,0 1,1 1,2 R.D. Botts, D.M. Carson, and D.Coglon. "Petroleum in our live" in Our petroleum challenge, 8th ed. Calgary:Canadian Center for Energy Development, 2013, pp. 7-15.
- ↑ American Chemical Society. "Methane and oxygen react". Internet: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson1, [October 25,2013]
- ↑ http://www.eia.gov/tools/faqs/faq.cfm?id=73&t=11

