Diferencia entre revisiones de «Lluvia ácida»
energy_spanish>Alba.fano-trabanco Sin resumen de edición |
m (1 revisión importada) |
(Sin diferencias)
| |
Revisión del 21:24 21 sep 2021
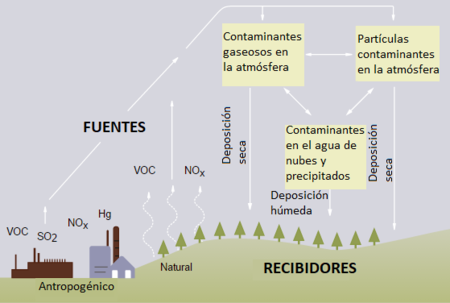
La deposición ácida es cualquier tipo de precipitación - lluvia, nieve, aguanieve, granizo o niebla - que tiene un pH más bajo (y por lo tanto es más ácida) de lo normal. Sin embargo, el término que casi siempre se utiliza para todas ellas es lluvia ácida. Esta mayor acidez puede causar problemas en los ecosistemas y en el medio ambiente, y sigue siendo una de las principales preocupaciones medioambientales derivadas del uso de los combustibles, a pesar de los intentos de solucionar el problema desde la década de 1970.[2]
La lluvia ácida se produce cuando el agua del aire se combina con los óxidos de nitrógeno y el dióxido de azufre, dos tipos de contaminantes, y luego cae sobre la superficie de la Tierra. Estos contaminantes también pueden acumularse en la superficie terrestre y la lluvia puede combinarse con ellos al llegar a la Tierra, por lo que a menudo se prefiere el término "deposición ácida" en lugar de lluvia ácida.[2]
Acidez
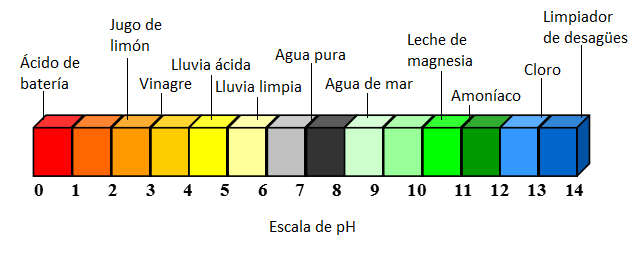
La lluvia normal tiene un pH de alrededor de 5.6, por lo que es ligeramente ácida. Esto se debe a la combinación del dióxido de carbono con el agua del aire para formar ácido carbónico.[3] Esta acidez se neutraliza de forma natural cuando la precipitación entra en contacto con minerales alcalinos como el calcio, el magnesio y el potasio en las rocas de la superficie de la Tierra. Este proceso de neutralización de la acidez es responsable de la erosión química de las rocas y de la liberación de bicarbonatos en el suelo y en los sistemas de agua, los cuales luego actúan como amortiguadores contra los aportes ácidos más fuertes.[2] La lluvia ácida, sin embargo, tiene un pH de alrededor de 4.2. Esto significa que la lluvia ácida es aproximadamente 25 veces más ácida que la lluvia normal debido a la característica logarítmica de la escala de pH.
Impactos
La lluvia ácida tiene muchos efectos perjudiciales sobre la vegetación, los ecosistemas de agua dulce y las estructuras naturales y artificiales. También puede provocar enfermedades respiratorias en los seres humanos, sobre todo en los que tienen afecciones preexistentes.[5] Cuando los lagos y otras masas de agua se vuelven demasiado ácidas, normalmente por debajo de un pH de 6.0, las plantas y la vida acuática empiezan a sufrir.[2] La capacidad de reproducción de los peces se tambalea, y la muerte o la deformación son generalizadas entre los peces más jóvenes. Los anfibios y los invertebrados sufren de forma similar, lo que significa que los lagos ácidos tienen muy poca o ninguna vida animal.[6]
Los impactos más notables se han medido en las secciones del noreste de Norteamérica y Europa occidental, y las fuentes de acidificación se han atribuido principalmente a las centrales eléctricas de carbón, que emiten grandes cantidades de NOx y SO2.[7] La acidez de las precipitaciones puede verse en la Fig. 3 en Estados Unidos, y debido a una combinación de flujos de viento procedentes de EE.UU. y la producción de contaminantes dentro de Canadá, el este de Canadá también sufre los efectos de la lluvia ácida.[8] Se han puesto en marcha diversas normativas y restricciones de contaminantes para solucionar el problema, y estas centrales deben utilizar dispositivos de control de la contaminación atmosférica para cumplirlas.

Después de que la lluvia ácida caiga a la Tierra, los efectos dependen del tipo de roca y suelo que encuentre. La piedra caliza es capaz de neutralizar el contenido de ácido de la lluvia, mientras que los lechos rocosos graníticos formados por granito, cuarzo y gneis no pueden hacerlo tan fácilmente.[8] El lecho rocoso de las regiones del noreste de la Fig. 3 está dominado por estos tipos de roca granítica y está recubierto únicamente por finas capas de suelo, lo que significa que la neutralización de las precipitaciones ácidas es lenta o inexistente.[7] Los lagos situados a mayor altura en estas regiones tienden a ser más ácidos y se consideran "muertos" si no son capaces de sustentar la vida.
La acumulación de nieve ácida en las montañas también es una consecuencia negativa, especialmente porque una gran cantidad del contenido ácido puede liberarse de golpe durante la primavera en la escorrentía de las montañas. Este choque químico es devastador para la vida vegetal río abajo.[7] Se sabe que muchos lagos de alta montaña han perdido sus poblaciones de peces debido al aumento de la acidez por la escorrentía del deshielo.[8]

Drenaje de Rocas Ácidas
Si las precipitaciones caen sobre rocas que contienen minerales que contienen azufre, como la pirita o la galena, la combinación del metabolismo de los microorganismos y la atmósfera oxidante puede dar lugar a una escorrentía con niveles de pH menor de tres, la cual es más de 100 veces más ácida que la precipitación tradicional.[11] Este tipo de escorrentía ácida se encuentra comúnmente en antiguos sitios mineros abandonados donde los minerales que contienen azufre fueron previamente extraídos para uso industrial y económico. Por ello, este tipo de deposición ácida se denomina a veces Drenaje Ácido de Minas. Cuando el pH de estas aguas de escorrentía se eleva sobre tres a medida que la escorrentía se neutraliza lentamente por los carbonatos del medio ambiente, el hierro previamente disuelto se precipita como compuestos de óxido de hierro. Esto da a las aguas una coloración amarilla-anaranjada característica conocida como Yellow boy, que en inglés significa Niño amarillo.
Prevención
Tras darse cuenta de los impactos de la lluvia ácida, se han puesto en marcha muchos programas para limitar la contaminación en todo el mundo desde los años 80.[12] Las emisiones de SO2 han disminuido en un 40% en Estados Unidos, y los niveles de lluvia ácida se redujeron en un 65% en 2005. Lo mismo ocurre con los NOx.[13] Esto es posible gracias al uso de dispositivos de control de la contaminación atmosférica, como los depuradores y los precipitadores electrostáticos. Las centrales eléctricas de carbón y otras instalaciones industriales requieren estos dispositivos para cumplir las restricciones de emisiones, y pueden reducir las emisiones de algunos contaminantes dañinos en un 99%.[13]
Ver Lecturas Adicionales
- Ácido
- Base
- La escala de pH
- Químico
- Agua
- Ciclo del agua
- O explore una página al azar
Referencias
- ↑ Wikimedia Commons [Online], Available: https://upload.wikimedia.org/wikipedia/commons/b/b1/Origins_of_acid_rain.svg
- ↑ 2,0 2,1 2,2 2,3 Pollution Probe. The Acid Rain Primer. Visit www.pollutionprobe.org
- ↑ USEPA (May 30, 2020). Acid Rain Students Site [Online]. Accessible: https://www3.epa.gov/acidrain/education/site_students/phscale.html
- ↑ Adapted from Energy: Its use and the Environment. See Reference 8
- ↑ B. Everett, G. Boyle, S. Peake and J. Ramage, "Penalties: Assessing the Environmental and Health Impacts of Energy Use," in Energy Systems and Sustainability, 2nd ed., Oxford, UK: Oxford, 2013, ch.13, pp.543
- ↑ R. Wolfson, "Air Pollution" in Energy, Environment, and Climate, 2nd ed., New York, NY: W.W. Norton & Company, 2012, ch. 6, sec. 2, pp. 129-142
- ↑ 7,0 7,1 7,2 J. Kraushaar and R. Ristinen, "Acid Rain," in Energy and Problems of a Technical Society, 2nd ed., Hoboken, NJ: Wiley, 1993, ch.14, sec.6, pp.404-407
- ↑ 8,0 8,1 8,2 Environment and Climate Change Canada (May 31, 2020). "Acid Rain FAQ" [Online]. Accessible: https://www.ec.gc.ca/air/default.asp?lang=En&n=7E5E9F00-1
- ↑ EPA. Acid Rain in New England [Online], Available: http://www.epa.gov/region1/eco/acidrain/intro.html
- ↑ Wikimedia Commons (June 1, 2020). [Online]. Accessible: https://commons.wikimedia.org/wiki/File:PA_AcidMineDrainage.jpg
- ↑ Warren, L.A. (2011). "Acid Rock Drainage". In: Reitner J., Thiel V. (eds) Encyclopedia of Geobiology. Encyclopedia of Earth Sciences Series. Springer, Dordrecht. [Online]. Accessible: https://link.springer.com/referenceworkentry/10.1007%2F978-1-4020-9212-1_3
- ↑ Nunez, Christina (June 1st, 2020). "Acid Rain, Explained" [Onine]. Accessible: https://www.nationalgeographic.com/environment/global-warming/acid-rain/
- ↑ 13,0 13,1 R. A. Hinrichs and M. Kleinbach, "Acid Rain," in Energy: Its Use and the Environment, 5th ed. Toronto, Ont. Canada: Brooks/Cole, 2006, ch.8, sec.C, pp.252-256

