Acide

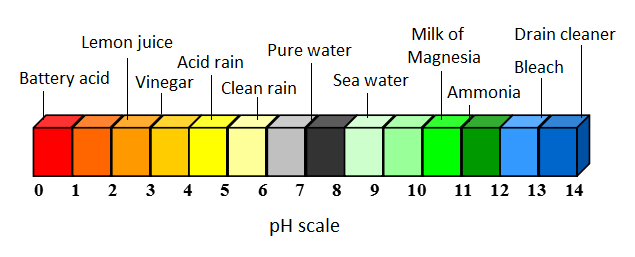
Un acide est une substance qui réagit avec l'eau pour produire du H+ [2] (H+ réagit dans l'eau pour produire H3O+ - les deux peuvent être traités comme équivalents). En général, les solutions acides dans l'eau ont un pH inférieur à 7.
Dans l'eau, il y a toujours des ions H+ et OH- en solution en raison de l'auto-ionisation de l'eau, mais dans les solutions acides, il y aura plus de H+ que de OH-. Les acides plus concentrés auront plus de H+ en solution. Suivant l'échelle de pH, une solution plus acide - une solution avec plus de H+ - aura une valeur de pH plus basse.
Les acides peuvent réagir avec les bases dans une réaction de neutralisation, où le H+ de l'acide réagit avec le OH- de la base pour produire une solution avec une concentration plus faible de H+ - et un pH plus élevé.
Les pluies acides sont un problème environnemental causé par la dissolution de substances acides dans l'eau de pluie. Ces substances acides proviennent souvent de la pollution de l'atmosphère. Les pluies acides, la neige acide et le brouillard acide (désignés collectivement par le terme « pluie acide ») peuvent tous se former à partir de l'interaction de la vapeur d'eau, de la pluie ou du brouillard avec des polluants acides. Les pluies acides peuvent être très nuisibles en raison de leur acidité - la pluie propre a un pH typique d'environ 5,6, tandis que la pluie acide a un pH typique d'environ 4,3 : en d'autres termes, la pluie acide est généralement environ 10 fois plus acide que la pluie propre. [3] Pour plus d'informations, consultez la page pluie acide.
Usages
Les acides sont présents à l'état naturel (par exemple dans les fruits et légumes) et les acides artificiels sont largement utilisés dans le secteur industriel, pour le nettoyage et comme additifs alimentaires. Par exemple, ils peuvent être utilisés pour éliminer la rouille des métaux, comme électrolyte dans une batterie humide (comme une batterie de voiture), dans l'industrie chimique en tant que composant important de la production, et en tant qu'additifs aux aliments et aux boissons pour modifier le goût et agir comme conservateur (par exemple dans les sodas).
Les acides sont également importants dans le corps humain. L'acide gastrique décompose les aliments lors de l'une des premières étapes de la digestion, et les acides organiques sont utilisés pour la synthèse des protéines, la réparation des tissus et la régulation du pH dans les tissus. L'acide ascorbique (vitamine C) est essentiel pour le corps humain, de même que de nombreux autres acides. Le « A » de l'ADN et de l'ARN signifie « acide », et ce sont des molécules essentielles à toute vie.
Simulation Phet
L'Université du Colorado nous a gracieusement autorisés à utiliser la simulation Phet suivante. Explorez cette simulation pour voir comment fonctionne le pH des acides et des bases.
En savoir plus
- Base
- L'échelle de pH
- Chimique
- Eau
- Pluie acide
- Cycle de l'eau
- Ou explorez une page au hasard
Pour en savoir plus sur les acides et les bases, veuillez consulter le LibreText sur la chimie.
Références
- ↑ Wikimedia Commons [Online], Available: https://commons.wikimedia.org/wiki/File:Lemon.jpg
- ↑ Chemistry LibreTexts. (July 11 2018). Overview of Acids and Bases [online], Available: https://chem.libretexts.org/Textbook_Maps/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Acids_and_Bases/Acid/Overview_of_Acids_and_Bases
- ↑ United States Environmental Protection Agency. (July 11 2018). What is Acid Rain [online], Available: https://www.epa.gov/acidrain/what-acid-rain
- ↑ Adapted from Energy: Its use and the Environment -- R. A. Hinrichs and M. Kleinbach, "Acid Rain," in Energy: Its Use and the Environment, 5th ed. Toronto, Ont. Canada: Brooks/Cole, 2006, ch.8, sec.C, pp.252-256

