« Atome » : différence entre les versions
energy_french>Luisa Aucun résumé des modifications |
m (1 version importée) |
(Aucune différence)
| |
Version actuelle datée du 28 septembre 2021 à 03:32
L'atome est l'unité la plus fondamentale d'un élément - tous les éléments ont des propriétés distinctes en raison de la structure de leurs atomes. Par exemple, un atome à la surface d'un cristal de silicium (voir figure 1) sera différent de ceux à la surface d'un cristal d'uranium. Le mot « atome » vient des racines grecques « a » (sans) et « tom » (couper).[3] Jusqu'au 20e siècle, on pensait que les atomes étaient la plus petite particule possible.
Composition

Le noyau est le composant central d'un atome, qui est extrêmement dense (voir figure 2). Il est composé de protons et de neutrons (collectivement appelés nucléons) et est responsable de la grande majorité de la masse atomique. Les protons et les neutrons sont maintenus ensemble dans le noyau par ce que nous appelons la force nucléaire forte (qui est la force la plus forte connue dans l'univers). Autour du noyau se trouve un nuage d'électrons beaucoup plus petits et plus légers, qui sont attirés vers le noyau par la force électromagnétique après avoir interagi avec les protons. Des quantités différentes de protons, de neutrons et d'électrons confèrent à l'atome des propriétés chimiques différentes, qui déterminent l'élément auquel il appartient.
Les atomes sont inimaginablement petits, et leurs noyaux sont 1000 fois plus petits. En effet, un centimètre cube de silicium, comme le montre la figure 1, contient environ 5 x 1022 atomes (c'est 5 avec 22 zéros après !). Veuillez consulter l'échelle de l'univers pour voir une représentation visuelle de la taille des atomes.
Identification de l'atome
Protons
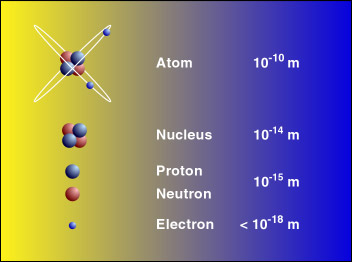
Un élément est identifiable par le nombre de protons que l'on trouve dans le noyau d'un de ses atomes (voir la figure 3) ; de plus, le nombre de protons dans l'atome détermine également la position de l'élément sur le tableau périodique des éléments. Par exemple, un atome de carbone possède exactement 6 protons dans son noyau et porte donc le numéro 6 sur le tableau périodique des éléments, le thorium possède exactement 90 protons et porte donc le numéro 90 sur le tableau périodique des éléments.
Électrons
Les atomes ont un nombre égal de protons et d'électrons ; cependant, un atome peut perdre ou acquérir un ou plusieurs électrons, devenant ainsi « déséquilibré » . Un atome déséquilibré est appelé un ion ; s'il « acquiert » un électron (il a donc plus d'électrons que de protons), il devient un ion de charge négative ou un « anion ». Si le contraire se produit et que l'atome perd un électron, il devient un ion de charge positive ou un « cation ». Les ions peuvent se lier facilement à d'autres ions, pour créer une grande variété de composés différents.
L'une des façons dont les atomes acquièrent ou perdent des électrons est le rayonnement à haute énergie. Ces rayonnements provoquent la formation d'ions et sont donc appelés rayonnements ionisants.
Neutrons
Les neutrons ont la même masse que les protons. Il est donc très facile de déterminer combien il en existe dans le noyau d'un atome. Il suffit de soustraire le nombre de protons de la masse atomique de l'atome pour obtenir le nombre de neutrons. Par exemple, le césium porte le numéro 55 sur le tableau périodique des éléments et possède donc 55 protons ; de plus, sa masse atomique (que l'on trouve généralement aussi sur le tableau périodique) est de 133 uma (unités de masse atomique). En soustrayant 55 de 133, on obtient 78, qui est donc le nombre de neutrons au sein de l'atome. Le même type d'atome (déterminé par le nombre de protons) peut avoir un nombre différent de neutrons. Ce sont les différents isotopes d'un atome. Par exemple, le carbone-12 (12C) est un isotope du carbone et le carbone-14 (14C) en est un autre. Ce sujet est abordé plus en détail à la page sur le noyau.
Connaissance du nucléaire
Notre équipe a créé une vidéo à ce sujet dans le flux de connaissances sur le nucléaire (en anglais, les versions français seront crée en avenir) :
Phet: construire un atome
Vous trouverez ci-dessous une simulation interactive PhET de l'Université du Colorado. Cette simulation permet de créer un atome à partir de protons, de neutrons et d'électrons et de tester ses compétences avec le tableau périodique des éléments.
Pour plus d'informations sur les atomes, veuillez consulter le wiki chimique de l'UC Davis.
Références
- ↑ For an explanation of these amazing microscopes please see hyperphysics
- ↑ Downloaded from http://phys.org/news70293607.html
- ↑ The Compact Oxford English dictionary pg 84, Oxford University Press, 2004.
- ↑ "The electron cloud" internet: http://letstalkaboutscience.wordpress.com/2012/02/16/the-electron-cloud/
- ↑ "Nature of the Universe: Chapter Eleven" internet:http://www.lcsd.gov.hk/CE/Museum/Space/EducationResource/Universe/framed_e/lecture/ch11/ch11.html


