« Butane » : différence entre les versions
Aucun résumé des modifications |
m (1 version importée) |
(Aucune différence)
| |
Version actuelle datée du 18 août 2021 à 10:32

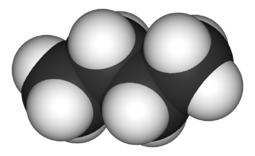
Le butane est un alcane de formule chimique C4H10, comme l'illustre la figure 2. En tant qu'hydrocarbure, il peut subir une combustion qui dégage de l'énergie thermique. Le butane est l'un des composants hydrocarbonés du gaz naturel brut, qui est un type de combustible fossile.[2] Le butane est généralement retiré du gaz naturel avant d'être expédié aux clients, mais il est ensuite vendu séparément comme combustible.
Aux températures et pressions typiques, le butane est un gaz qui soit seul, soit mélangé avec du propane ([math]\ce{ C3H8 }[/math]), produit du gaz de pétrole liquéfié (GPL). [3] Le pourcentage de butane et de propane dans le GPL varie en fonction de l'utilisation du GPL et du climat dans lequel il est utilisé. [3] Le GPL pourrait même être entièrement composé de propane.
Le butane est généralement mélangé avec du propane dans le carburant de camping afin de maintenir des pressions plus élevées aux basses températures.[4] Le butane est également l'un des principaux composants des fluides pour les briquets. Il est couramment utilisé dans les briquets, les cuisinières portables et les chalumeaux à butane. La figure 1 montre un chalumeau à butane utilisé dans la cuisine.
Propriétés
Voici un tableau de certaines propriétés du butane:
| Formule chimique | C4H10 |
| Masse molaire | 58.12 grammes/mole |
| Densité énergétique | 49.5 MJ/kg[6] |
| Point de fusion | -138oC[7] |
| Point d'ébullition | -0.5oC[7] |
Réaction de combustion
Le butane libère son énergie chimique en subissant une combustion d'hydrocarbures. Ci-dessous vous trouverez une animation de combustion d'hydrocarbures qui montre la réaction nette qui se produit lorsque le butane se combine avec l'oxygène.
La réaction de combustion d'hydrocarbures libère de l'énergie thermique et constitue un exemple de réaction exothermique. La réaction a également une valeur de changement d'enthalpie négative (ΔH).
En savoir plus
- Énergie chimique
- Liaison chimique
- Combustion
- Énergie primaire
- Technologie de conversion d'énergie
- Ou explorez une page au hasard
Références
- ↑ [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0) or GFDL (http://www.gnu.org/copyleft/fdl.html)], via Wikimedia Commons accessed 1/29/2015.
- ↑ “NATURAL GAS FAQs,” Pacific Northern Gas RSS. [Online]. Available: http://www.png.ca/natural-gas-faqs/. [Accessed: 24-May-2017]
- ↑ 3,0 et 3,1 Hahn, E. (2020). What is the Percentage of Propane and Butane in LPG Gas Mixture - Which Gas is Present in LPG. [online] Elgas.com.au. Available at: https://www.elgas.com.au/blog/1972-lpg-contains-which-gases-gases-present-in-lpg-gases-used [Accessed 26 Jan. 2020].
- ↑ MSR.(2014). MSR ISOPRO - Performance Boosting Fuel for your Canister Stove [Online]. Available: http://www.cascadedesigns.com/msr/stoves/stove-accessories/msr-isopro/product [February 16, 2015].
- ↑ "Butane-3D-space-filling". Licensed under Public Domain via Wikimedia Commons - http://commons.wikimedia.org/wiki/File:Butane-3D-space-filling.png#mediaviewer/File:Butane-3D-space-filling.png
- ↑ Glenn Elert. (2015). The Physics Hypertextbook - Chemical Potential Energy [Online]. Available: http://physics.info/energy-chemical/ [February 16, 2015].
- ↑ 7,0 et 7,1 Charles E. Ophardt. (2003). Virtual Chembook - Hydrocarbon Boiling Points [Online]. Available: http://www.elmhurst.edu/~chm/vchembook/501hcboilingpts.html [February 16,2015].
<languages />