Carbone
Le carbone (C) est le 6e élément du tableau périodique. C'est aussi le 6e élément le plus abondant de l'Univers.[2] La particularité du carbone vient de ses quatre électrons de valence qui le rendent très polyvalent et lui permettent de se lier avec de nombreux autres éléments, y compris avec d'autres atomes de carbone. Il existe plus de 10 millions de composés connus contenant du carbone.[3]
Le carbone et ses différents composés jouent un rôle essentiel dans le monde dans lequel nous vivons. Le carbone lui-même est très important, car ses atomes se lient et forment des diamants, du graphite et d'autres formes de carbone. Le carbone en soi n'est pas nécessairement nuisible, mais c'est lorsqu'il est inclus dans d'autres molécules qu'il peut présenter un problème. Bien qu'il y ait plus de 10 millions de composés de carbone, la science de l'énergie est principalement préoccupée par quelques-uns d'entre eux, notamment :
- le dioxyde de carbone (CO2) et
- les nombreux hydrocarbures.
Les hydrocarbures et le CO2 sont étroitement liés, comme nous le verrons dans la section suivante.
Carbone dans les combustibles
Les hydrocarbures sont des molécules qui contiennent du carbone et de l'hydrogène. Ils constituent les combustibles que le monde utilise pour obtenir environ 95 % de son énergie primaire.[4] Lorsqu'on utilise des hydrocarbures pour produire de l'énergie, l'un des produits fabriqués est le CO2. Les hydrocarbures sont le principal constituant des combustibles fossiles, tel que le gaz naturel, le pétrole et le charbon, d'où provient une grande partie de l'énergie mondiale. Les combustibles fossiles fournissent la plupart de l'électricité mondiale ainsi que les carburants de transport les plus dominants, tels que l'essence et le diesel.
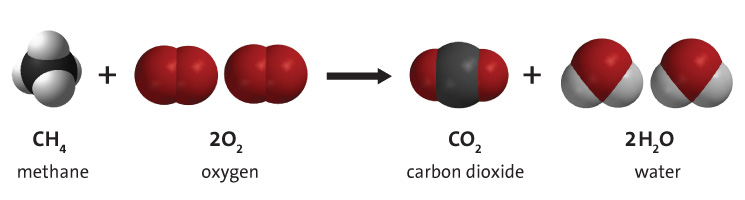
C'est par le processus de combustion des hydrocarbures que l'énergie est exploitée à partir des combustibles fossiles. Un hydrocarbure réagit avec l'oxygène moléculaire, produisant du dioxyde de carbone et de la vapeur d'eau, comme le montre la figure 2. Les différents types d'hydrocarbures produisent différentes quantités de dioxyde de carbone, le charbon en produisant le plus.[5]
Carbone dans l'atmosphère
La combustion des hydrocarbures produit du dioxyde de carbone, qui est un gaz à effet de serre. Le dioxyde de carbone absorbe et réémet le rayonnement infrarouge vers la Terre (comme on peut le voir à la figure 3), causant un changement climatique. Bien que les gaz à effet de serre soient nécessaires pour maintenir des températures habitables sur Terre (cliquez ici pour plus d'informations), l'augmentation de ces gaz dans l'atmosphère contribue au réchauffement planétaire. La gestion des émissions de CO2 provenant de l'utilisation des combustibles fossiles est une préoccupation technologique, économique et politique.[8]
Le méthane (CH4), le monoxyde de carbone et le carbone noir sont tous présents dans l'atmosphère, et chacun a des effets variés sur la planète. Les quantités de ces éléments dans l'atmosphère ont augmenté rapidement : celle de dioxyde de carbone - d'environ 35 % au cours de l'ère industrielle et celle du méthane - d'environ 250 %. Avant cette période, ces niveaux étaient relativement constants pendant près de 10 000 ans.[9] L'effet de forçage climatique du méthane est environ un tiers de celui du dioxyde de carbone, il est donc considéré comme le deuxième gaz à effet de serre le plus important. On sait que cette augmentation est due aux activités humaines, principalement à la consommation de combustibles fossiles et à la déforestation.[10]
Cycle naturel du carbone
Le dioxyde de carbone, le méthane et d'autres hydrocarbures sont des composants naturels du cycle du carbone, qui est l'ensemble de toutes les formes de carbone présentes sur la planète, de l'océan aux couches supérieures de l'atmosphère.
Le cycle du carbone naturel se maintient presque à l'équilibre. Les animaux et les plantes émettent du CO2 dans l'atmosphère par la respiration, tandis que les plantes l'absorbent par le processus de photosynthèse. Il existe également un cycle de CO2 entre l'atmosphère et l'océan, réalisé dans un équilibre presque parfait. Ce cycle se produit rapidement, car une molécule typique de CO2 ne reste dans l'atmosphère qu'environ 5 ans.[11]
Effets humains sur le cycle du carbone
Les êtres humains affectent le cycle naturel du carbone principalement par l'utilisation de combustibles fossiles, la fabrication de ciment et le déboisement forestier, comme le montre en rouge la figure 4 ci-dessous. Il en résulte une augmentation globale des emissions de carbone dans l'atmosphère et les océans, ce qui contribue au réchauffement planétaire ainsi qu'à l'acidification des océans.
Ces deux phénomènes peuvent avoir des conséquences désastreuses sur le cycle du carbone, car ils peuvent potentiellement amplifier les emissions de carbone dans l'atmosphère. Par exemple, les incendies de forêt provoqués par le réchauffement planétaire pourraient restituer une grande partie de CO2 que la vie végétale est censée éliminer de l'atmosphère. L'acidification des océans grâce à une absorption accrue de CO2 peut nuire à la vie marine, qui joue un rôle important dans le cycle du carbone de l'océan.[11]
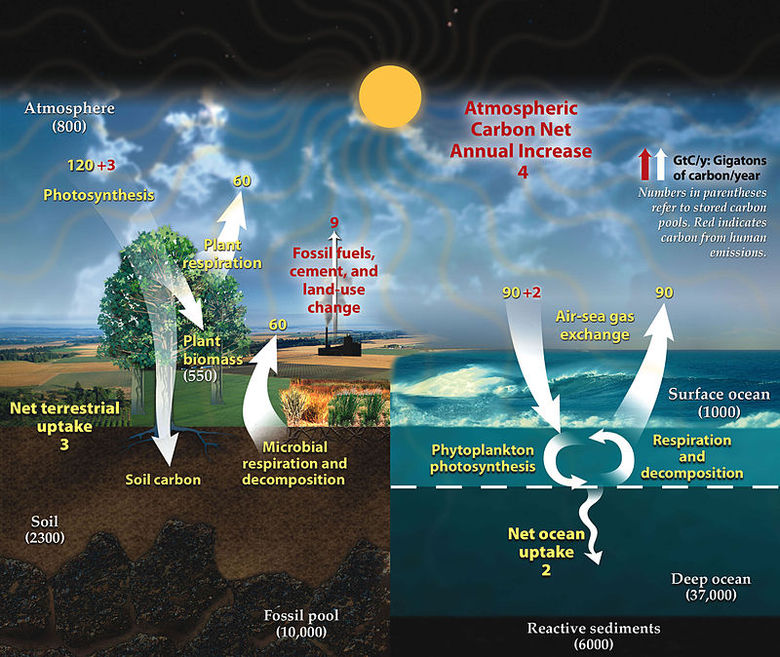
Destin du carbone dans l'atmosphère
Il a déjà été mentionné qu'une molécule de dioxyde de carbone typique ne reste dans l'atmosphère que pendant environ 5 ans. Cela semble prometteur, mais ce n'est pas tout. Si les êtres humains cessaient instantanément d'influer sur le cycle du carbone, il faudrait environ 100 ans pour que la moitié du carbone qu'ils ont émis dans l'atmosphère descende dans les profondeurs des océans ou des sols. Cependant, comme il y a de moins en moins de carbone d'origine humaine dans le cycle, il faut plus de temps pour que le cycle s'en débarrasse. Ce n'est qu'après des milliers d'années que ce carbone sera presque totalement éliminé, et à ce moment-là, il sera peut-être déjà trop tard pour en inverser les effets.[11]
Vidéo
La vidéo ci-dessous est de l'Université de Nottingham periodic videos project.[13] Ils ont créé une suite complète de vidéos courtes sur chaque élément de la table périodique des éléments.
En savoir plus
- Capture et stockage du carbone
- Agriculture du carbone
- Émissions anthropiques de carbone
- C vs CO2
- Ou explorez une page au hasard.
Références
- ↑ Créé en interne par un member de l'équipe Energy Education.
- ↑ Jefferson Lab, 10 Most Abundant Elements in the Universe [Online], Available: http://education.jlab.org/glossary/abund_uni.html
- ↑ Los Alamos National Laboratory, Carbon [Online], Available: http://web.archive.org/web/20080913063402/http://periodic.lanl.gov/elements/6.html
- ↑ Données de l'OCDE, visitez la page énergie primaire pour plus de détails.
- ↑ R.D. Botts, D.M. Carson, and D.Coglon. "Petroleum in our live" in Our petroleum challenge, 8th ed. Calgary:Canadian Center for Energy Development, 2013, pp. 7-15.
- ↑ American Chemical Society. "Methane and oxygen react". Internet: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson1, [October 25,2013]
- ↑ PhET Simulations, Molecules and Light [Online], Available: https://phet.colorado.edu/en/simulation/molecules-and-light
- ↑ The Encyclopedia of Earth, Carbon [Online], Available: http://www.eoearth.org/view/article/150918/
- ↑ IPCC, The Natural Carbon Cycle [Online], Available: https://www.ipcc.ch/publications_and_data/ar4/wg1/en/ch7s7-3.html
- ↑ IPCC, FAQ: What Factors Determine Earth’s Climate? [Online], Available: https://www.ipcc.ch/publications_and_data/ar4/wg1/en/faq-1-1.html
- ↑ 11,0 11,1 et 11,2 R. Wolfson, "Carbon: A Closer Look" in Energy, Environment, and Climate, 2nd ed., New York, NY: W.W. Norton & Company, 2012, ch. 13, sec. 5, pp. 357-361
- ↑ Wikimedia Commons [Online]. (June 5 2015). Available: http://en.wikipedia.org/wiki/Carbon_cycle#/media/File:Carbon_cycle.jpg
- ↑ Pour voir d'autres vidéos de l'Université de Nottingham sur différents éléments, cliquez ici : http://www.periodicvideos.com/


