Chaleur vs température
La chaleur et la température sont deux sujets étroitement liés, c'est pourquoi la différence entre les deux peut être un peu déroutante. La différence principale réside dans le fait que la chaleur traite de l'énergie thermique, alors que la température est plus reliée à l'énergie cinétique moléculaire.
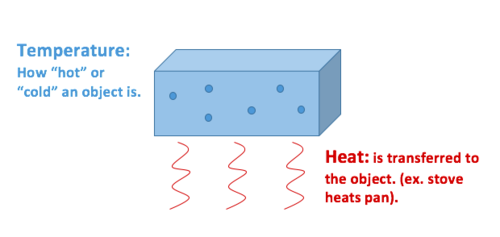
Quelle est la différence?
La chaleur décrit le transfert d'énergie thermique entre les molécules d'un système et est mesurée en joules.[2] La chaleur mesure le déplacement ou l'écoulement de l'énergie. Un objet peut gagner ou perdre de la chaleur, mais il ne peut pas « avoir de la chaleur ». La chaleur est une mesure de changement, jamais une propriété possédée par un objet ou un système. Par conséquent, elle est classée comme une variable de processus.
La température décrit l'énergie cinétique moyenne des molécules dans un matériau ou dans un système et est mesurée en Celsius (°C), Kelvin (K), Fahrenheit (°F) ou Rankine (R). Il s'agit d'une propriété physique mesurable d'un objet, également appelée « variable d'état ». D'autres propriétés physiques mesurables comprennent la vitesse, la masse et la densité, pour n'en nommer que quelques-unes.[3]
Similarités
La chaleur est un transfert d'énergie thermique provoqué par une différence de température entre les molécules.
Remarque:
L'énergie thermique peut être autrement comprise comme l'énergie cinétique et potentielle microscopique d'un système.
Deuxième loi de la thermodynamique
La deuxième loi de la thermodynamique est un sujet complexe qui nécessite une étude approfondie dans le domaine de la thermodynamique pour être bien compris. Cependant, pour les besoins de cet article, seulement un petit aspect de ce thème doit être compris, et c'est le fait que la chaleur passera toujours spontanément des substances plus chaudes vers des substances plus froides. Cette simple déclaration explique pourquoi un glaçon ne se forme pas dehors par une journée chaude ou pourquoi il fond lorsqu'il est déposé dans un bol d'eau chaude.
Expérience de pensée
Imaginez que le glaçon mentionné ci-dessus tombe dans un bol d'eau chaude - la glace doit gagner de la chaleur (de l'énergie thermique) depuis l'eau du bol (voir le paragraphe précédent). L'ajout d'énergie thermique entraîne une augmentation dans l'énergie cinétique de la molécule de glace et, par conséquent, une augmentation de la température. Ceci est connu car la température est en fait la mesure de l'énergie cinétique moyenne des molécules. De plus, la glace continuera à gagner de l'énergie thermique, ce qui accélérera le déplacement de ses molécules et finira par rompre leurs liaisons intermoléculaires ou par fondre.
En conclusion, le transfert de chaleur, ou d'énergie thermique, modifie d'habitude la température de la substance, mais pas toujours! Par exemple, au moment où la glace dans le bol se transforme en eau, ces molécules d'eau seront exactement à la même température que lorsqu'elles étaient sous forme de glace. Dans ce cas, au lieu de faire du travail pour augmenter l'énergie cinétique, l'énergie thermique travaille pour rompre les liaisons intermoléculaires, provoquant un changement d'état. Cependant, avec le temps, la température de la glace récemment fondue augmentera jusqu'à ce que tout ce qui se trouve dans le bol atteigne l'équilibre, c'est-à-dire une température constante partout.
En savoir plus
- Chaleur
- Température
- Énérgie thermique
- Énergie cinétique
- Énergie interne
- Ou explorez une page au hasard

