Eau lourde
L'eau lourde est l'eau qui contient de l'hydrogène lourd, également connu comme deutérium, à la place de l'hydrogène ordinaire. Il peut également être écrit comme 2H2O ou D2O. Le deutérium est différent de l'hydrogène habituellement présent dans l'eau, appelé protium, car chaque atome de deutérium contient un proton et un neutron. Par contre, l'hydrogène ordinaire ne contient qu'un seul proton, d'où vient son nom de « protium ».[2]
L'eau lourde existe dans la nature mais en quantités beaucoup plus faibles que l'eau ordinaire. Il y a environ une molécule d'eau lourde sur vingt millions de molécules d'eau standard. Étant donné que le deutérium est un isotope stable, l'eau lourde n'est pas radioactive.[3]
L'eau lourde est un matériau important pour les réacteurs nucléaires. En outre, elle a été utilisée au Canada pour détecter les neutrinos provenant du Soleil à l'Observatoire de neutrinos de Sudbury, fournissant des informations importantes sur la physique subatomique.
Utilisation en tant que modérateur
Dans les réacteurs de fission nucléaire, les neutrons doivent être ralentis pour qu'une réaction en chaîne de fission se produise. Ce processus de ralentissement des neutrons est appelé modération, et le matériau qui ralentit ces neutrons est appelé modérateur de neutrons. L'eau lourde est l'un des deux modérateurs qui permettent d'utiliser l'uranium naturel comme combustible, l'autre étant le graphite.[4]
Un réacteur à eau lourde utilise l'eau lourde comme caloporteur et modérateur. Le deutérium sert de modérateur, car il absorbe moins de neutrons que l'hydrogène. Ceci est extrêmement important, car les réactions de fission nucléaire nécessitent des neutrons pour effectuer leurs réactions en chaîne.[5] L'eau lourde est maintenue sous pression, ce qui augmente son point d'ébullition afin qu'elle puisse fonctionner à des températures élevées sans bouillir. Les réacteurs CANDU utilisent l'eau lourde comme modérateur et n'ont donc pas besoin d'uranium enrichi, car l'uranium naturel peut être utilisé à sa place.
Production
Le coût de l'eau lourde constitue une grande partie du coût de construction d'un réacteur à eau lourde mais rend les réacteurs moins chers à exploiter (car l'enrichissement de l'uranium n'est pas nécessaire). D'un point de vue technique, le deutérium n'est pas fabriqué mais plutôt récolté lorsque des molécules d'eau lourde sont séparées des grandes quantités d'eau par le procédé au sulfure de Girdler. L'eau qui n'est pas lourde, connue comme « eau épuisée », est rejetée. Une autre méthode consiste à électrolyser l'eau pour obtenir de l'oxygène et de l'hydrogène contenant du gaz normal ainsi que du deutérium.[4] L'hydrogène est ensuite liquéfié et distillé pour séparer les deux composants, après quoi le deutérium réagit avec l'oxygène pour former de l'eau lourde.
La production d'eau lourde nécessite une infrastructure avancée. Elle est activement produite en Argentine, au Canada, en Inde et en Norvège. La plus grande usine était celle de Bruce au Canada, mais elle est maintenant fermée. Techniquement, il existe une faible différence entre le point d'ébullition de l'eau lourde et celui de l'eau. Cette différence pourrait donc être exploitée pour l'extraction de l'eau lourde.[4] Cependant, comme le deutérium existe en si petites quantités, il faudrait faire bouillir une énorme masse d'eau pour obtenir des concentrations significatives de deutérium. Comme cela nécessiterait beaucoup de combustible ou d'électricité, les installations exploitent plutôt les différences chimiques entre les deux. La méthode chimique la plus importante de production d'eau lourde est le procédé au sulfure de Girdler.
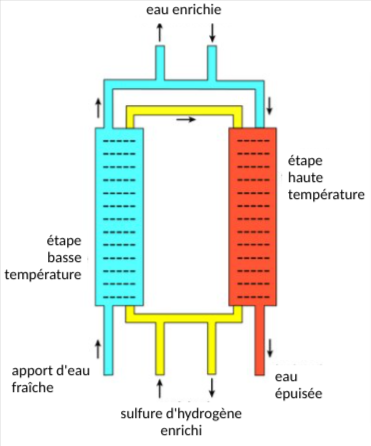
Le procédé au sulfure de Girdler est une méthode basée sur un échange de deutérium entre H2S et l'eau légère ordinaire. Dans ce processus, il existe deux colonnes distinctes. La première colonne, appelée « tour froide », est à 30 °C, et l'autre, appelée « tour chaude », est à 130 °C. La séparation survient en fonction des comportements d'équilibre et des différences d'équilibre aux deux températures. L'équation de l'équilibre est :[4]
La circulation du gaz sulfure d'hydrogène entre les deux tours est essentielle à ce processus. Tout d'abord, l'eau douce se déverse dans l'étape de basse température avec du sulfure d'hydrogène gazeux enrichi en deutérium. En raison des propriétés d'équilibre à cette température, le deutérium migre préférentiellement du sulfure d'hydrogène enrichi vers l'eau, créant ainsi de l'eau lourde. L'eau enrichie est ensuite retirée, et une plus grande quantité d'eau fraîche entre dans l'étape de haute température avec le sulfure d'hydrogène gazeux (maintenant légèrement appauvri en deutérium). Ici, tout deutérium provenant de l'eau douce se déplace préférentiellement vers le sulfure d'hydrogène gazeux, l'enrichissant. Ce gaz enrichi retourne ensuite dans l'étape de basse température, où il enrichit encore l'eau lourde. L'eau normale de l'étape de haute température, maintenant épuisée, est retirée. Une cascade est ensuite mise en place pour que l'eau enrichie (l'eau contenant plus de deutérium) soit introduite dans la tour froide et enrichie encore plus.[4]
Références
- ↑ Wikimedia Commons. (June 16, 2015). Heavy Water [Online]. Available: https://upload.wikimedia.org/wikipedia/commons/e/e4/Heavy-water-3D-vdW.svg
- ↑ Anne Marie Helmenstine. (June 16, 2015). What Is Heavy Water? [Online]. Available: http://chemistry.about.com/od/waterchemistry/f/What-Is-Heavy-Water.htm
- ↑ Anne Marie Helmenstine. (June 16, 2015). Is Heavy Water Radioactive? [Online]. Available: http://chemistry.about.com/od/waterchemistry/f/Is-Heavy-Water-Radioactive.htm
- ↑ 4,0 4,1 4,2 4,3 et 4,4 Federation of American Scientists. (June 17, 2015). Heavy Water Production [Online]. Available: https://fas.org/nuke/intro/nuke/heavy.htm
- ↑ R. Wolfson, "Nuclear fission" in Energy, Environment, and Climate, 2nd ed., New York, NY: W.W. Norton & Company, 2012, ch. 7, sec. 4, pp.173
- ↑ Wikimedia Commons. (June 18, 2015). Girdler Process [Online]. Available: https://upload.wikimedia.org/wikipedia/commons/thumb/4/45/Girdler.svg/640px-Girdler.svg.png

