« Hydrogène » : différence entre les versions
energy_french>Luisa Aucun résumé des modifications |
m (1 version importée) |
(Aucune différence)
| |
Version actuelle datée du 28 septembre 2021 à 03:32
Hydrogène est le premier élément du tableau périodique des éléments, et l'élément le plus abondant dans l'univers : il représente 75% de la masse totale de tous les éléments de l'univers.[2] Certaines de ses propriétés sont énumérées ci-dessous :[3]
| Masse atomique | 1,00794 |
| Densité (at 0oC) | 0,0899 g/L |
| Point d'ébullition | 20,28 K |
| Point de fusion | 13,81 K |
C'est le combustible brut que les étoiles comme le Soleil « brûlent » dans le processus de fusion nucléaire. Ce processus dégage de l'énergie sous forme de rayonnement électromagnétique (lumière), dont une partie finit par atteindre la Terre, fournissant la chaleur et l'énergie nécessaires à la vie. Le même processus est étudié par les scientifiques dans l'espoir d'en faire une source d'énergie pour l'humanité.[3]
L'hydrogène tient une importance considérable dans le fonctionnement des étoiles, mais il est également très utile sur la Terre. Il est rarement à l'état libre sur Terre, mais se combine avec de nombreux éléments pour former des molécules importantes pour la vie. Il s'agit notamment de l'eau, des hydrocarbures comme le méthane et le propane, du glucose et de l'ammoniac.
Hydrogène dans les carburants
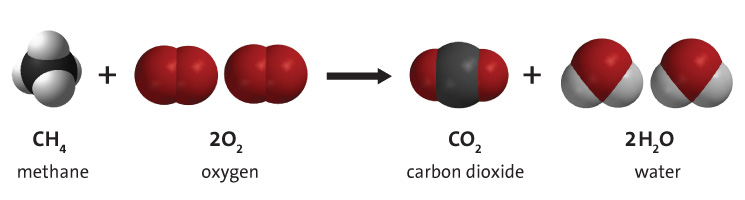
L'hydrogène est un composant clé des combustibles tels que le charbon, le gaz naturel et le pétrole, en raison de son inclusion dans la molécule primaire qui les compose : les hydrocarbures. Dans ces derniers, l'hydrogène se lie au carbone dans plusieurs combinaisons différentes, et ces molécules peuvent être brûlées en présence d'oxygène moléculaire pour donner de l'énergie utile. Ce processus est illustré à la figure 2. L'hydrogène, qui fait partie de l'hydrocarbure, se combine avec l'oxygène pour former de la vapeur d'eau. Le processus ci-dessous montre la combustion du méthane, mais de nombreux hydrocarbures différents peuvent provoquer la même réaction, cependant, les quantités de CO2 et de H2O seront différentes. Ce processus fournit au monde la majorité de son énergie primaire - environ 95 %.[4]
L'hydrogène comme combustible
L'hydrogène sous sa forme moléculaire (H2) peut être utilisé comme combustible, fournissant une énergie utile. Bien que l'hydrogène soit une devise énergétique plutôt qu'une source d'énergie, il est toujours considéré comme un combustible. Il nécessite une « combustion » en présence d'oxygène moléculaire, et ce processus crée de la chaleur qui peut être utilisée comme travail. Le seul sous-produit de cette réaction est l'eau et quelques oxydes d'azote.[6]
L'hydrogène sous cette forme n'existant pas à l'état naturel sur Terre, il doit être fabriqué par apport d'énergie. Il existe de nombreuses façons de produire de l'hydrogène, comme le processus d'électrolyse utilisant l'hydroélectricité, l'énergie solaire, l'énergie éolienne et l'énergie nucléaire.[6] L'industrie mondiale de l'hydrogène produit plus de 50 millions de tonnes d'hydrogène chaque année.
Outre la combustion dans un moteur, l'hydrogène peut également être stocké afin d'être utilisé dans des piles à combustible, de sorte qu'il peut être utilisé comme une batterie dans laquelle il peut convertir son énergie en électricité. Ils sont utilisés dans les voitures et les bus, le fonctionnement de ces véhicules étant essentiellement exempt d'émissions.[7] Une pile à combustible a une plus grande densité énergétique que les piles au lithium-ion en volume et en masse, et est également 2 à 3 fois plus efficace que les moteurs à combustion interne traditionnels.[7]
L'hydrogène constitue un combustible excellent pour de nombreuses raisons :[6]
- Sans carbone
- Nette
- Non-toxique
- Sans odeur
- Plus léger que l'air
- Sûr pour la production, le stockage et le transport
Isotopes
L'hydrogène a trois formes principales : le protium, le deutérium et le tritium. Visitez isotopes de l'hydrogène pour en savoir plus sur chacun d'eux.
| Nom | Symbole |
|---|---|
| Protium | 1H |
| Deutérium | 2H |
| Tritium | 3H |
Vidéo
La vidéo ci-dessous provient du projet de vidéos périodiques de l'Université de Nottingham.[8] Ils ont créé une série complète de courtes vidéos sur chaque élément du tableau périodique des éléments.
Références
- ↑ Fait en interne par un membre de l'équipe Energy Education, avec des informations provenant de periodictable.com, Available: http://periodictable.com/Elements/001/index.html
- ↑ Periodic Table, Hydrogen [Online], Available: http://periodictable.com/Elements/001/index.html
- ↑ 3,0 et 3,1 Jefferson Lab, The Elemental Hydrogen [Online], Available: http://education.jlab.org/itselemental/ele001.html
- ↑ Données de l'OCDE, visitez énergie primaire pour plus de détails.
- ↑ American Chemical Society. "Methane and oxygen react". Internet: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson1, [October 25,2013]
- ↑ 6,0 6,1 et 6,2 CHFCA, What is Hydrogen? [Online], Available: http://www.chfca.ca/education-centre/what-is-hydrogen/
- ↑ 7,0 et 7,1 CHFCA. Cars and Buses [Online], Available: http://www.chfca.ca/say-h2i/cars-and-buses/
- ↑ Vous pouvez voir d'autres vidéos de l'Université de Nottingham sur différents éléments ici : http://www.periodicvideos.com/