Pile à combustible
Les piles à combustible sont un type de technologie de conversion de l'énergie qui utilise l'énergie chimique contenue dans un combustible et la transforme en électricité avec certains sous-produits (en fonction du combustible utilisé). [1] Il est important de noter que les piles à combustible ne sont pas des machines thermiques, et qu'elles peuvent donc avoir des rendements élevés. Cependant, lorsqu'un machine thermique est utilisé pour alimenter une pile à combustible, le machine thermique a toujours un rendement thermique limité.
Les piles à combustible peuvent être considérées comme un dispositif de stockage d'énergie, car l'énergie peut être utilisée pour créer de l'hydrogène et de l'oxygène, qui peuvent rester dans la pile jusqu'à ce que leur utilisation soit nécessaire ultérieurement. En ce sens, elles fonctionnent un peu comme une batterie. Il existe de nombreux types de piles à combustible, mais deux types courants sont la pile à combustible à oxyde solide (SOFC) et la pile à combustible à membrane électrolyte polymère (PEMFC).
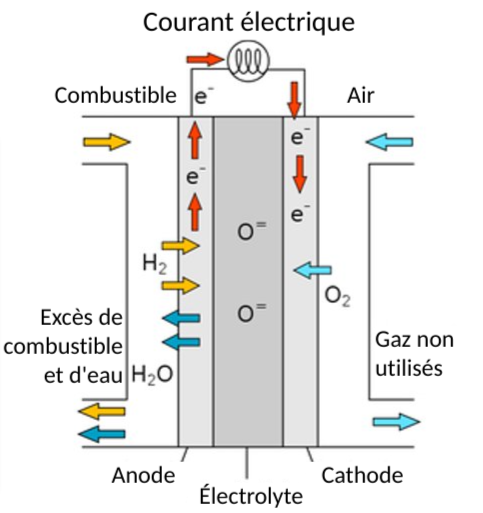
Figure 1. Diagramme d'une pile à combustible à oxyde solide (SOFC). L'oxygène moléculaire (O2-) se transforme en ions d'oxyde et se combine avec l'hydrogène pour former l'eau, tout en produisant simultanément l'électricité.[2]
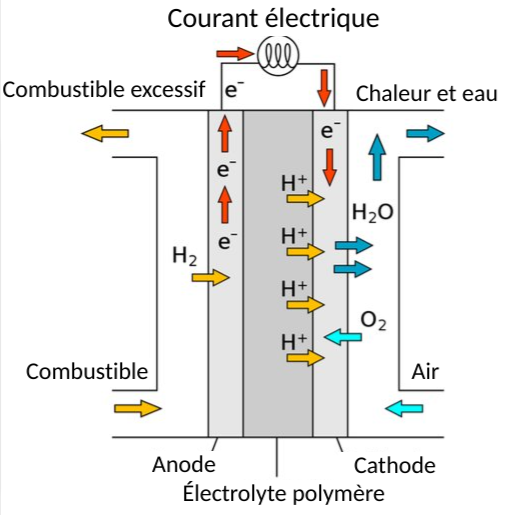
Figure 2. Diagramme d'une pile à combustible à membrane électrolyte polymère (PEMFC). L'hydrogène moléculaire (H+) se transforme en ions d'hydrogène qui traversent un électrolyte polymère. Les ions d'hydrogène se combinent avec l'oxygène pour former de l'eau, tout en produisant simultanément de l'électricité.[3]
Pour produire de l'électricité dans une pile à combustible à oxyde solide, l'oxygène de l'air se combine avec des électrons libres pour former des ions d'oxyde. Les ions oxyde traversent un électrolyte céramique et réagissent avec l'hydrogène moléculaire pour former de l'eau. La réaction qui produit l'eau libère également des électrons qui se déplacent dans un circuit électrique externe, produisant de l'électricité.[4] This process can be seen in figure 1.
Pour produire de l'électricité dans une pile à combustible à membrane électrolyte polymère, un combustible gazeux est introduit et réagit avec un catalyseur composé de nanoparticules de platine. Lorsque l'hydrogène moléculaire entre en contact avec ce catalyseur, il se divise en deux ions H+ et deux électrons. Les électrons sont conduits par une force électromotrice et de l'électricité est produite. Les ions hydrogène traversent une membrane échangeuse de protons (également appelée électrolyte polymère) où ils atteignent la cathode et se combinent à l'oxygène pour former de l'eau. Ce processus peut se poursuivre tant que de l'hydrogène et de l'oxygène sont fournis à la cellule.[1] La figure 2 montre ce processus dans une PEMFC.
La vidéo ci-dessous de la NASA illustre comment l'oxygène et l'hydrogène s'associent dans une pile à combustible à oxyde solide (SOFC) pour libérer de l'énergie qui peut être exploitée de manière utile (anglais).
Hydrogène
L'hydrogène est un combustible intéressant à utiliser dans les piles à combustible, qui fait l'objet de recherches et de développements actifs. Les raisons de l'utilisation de l'hydrogène ne tiennent pas seulement à sa haute densité énergétique (121 MJ/kg),[5] mais parce que le seul sous-produit, à part l'électricité, est l'eau.
Bien que l'hydrogène soit l'élément le plus abondant dans l'univers, il n'existe pas sous sa forme élémentaire sur Terre. L'hydrogène doit donc être fabriqué en introduisant de l'énergie dans des composés de l'hydrogène comme les hydrocarbures ou l'eau. Selon la manière dont il est réalisé, le processus peut également libérer des polluants. Environ 96 % de l'hydrogène produit est obtenu en utilisant du gaz naturel et d'autres combustibles fossiles, ce qui entraîne des émissions considérables de CO2. Toutefois, pour l'avenir, il est préférable d'utiliser des méthodes plus propres pour obtenir de l'hydrogène (c'est-à-dire de l'eau).[1][6]
Une autre façon de produire de l'hydrogène provient de l'énergie nucléaire. Pendant les périodes creuses (lorsque le réseau électrique n'a pas besoin d'autant d'électricité), les centrales nucléaires peuvent utiliser leur électricité pour produire de l'hydrogène. La chaleur générée par le réacteur nucléaire peut également être utilisée pour la production d'hydrogène. Les centrales à cycle combiné produisant à la fois de l'hydrogène et de l'électricité peuvent atteindre un rendement de 60 %.[7] De nombreux réacteurs nucléaires de génération IV sont en cours de conception dans le but de produire de l'hydrogène.
Utilisation de piles à combustible
De nombreux pays consacrent d'énormes sommes d'argent au développement des piles à hydrogène. La combustion de produits pétroliers (ou de tout autre combustible fossile) produit de la pollution ; plus précisément, la combustion libère du dioxyde de carbone qui contribue au réchauffement planétaire et finalement au changement de climat.[1]
Les utilisations des piles à combustible vont des grandes centrales électriques aux petits appareils tels que les téléphones cellulaires ou les ordinateurs portables.
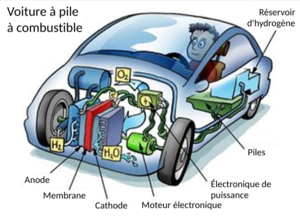
Dans les véhicules
L'utilisation la plus prometteuse de l'hydrogène comme carburant (dans un avenir immédiat) est celle des véhicules - et il y a déjà des véhicules à hydrogène sur la route aujourd'hui. L'efficacité maximale théorique des piles à combustible à hydrogène est de 83 %, avec des rendements réalistes autour de 60 %.[9] Combinés à un moteur électrique d'un rendement de 90 %, les véhicules peuvent atteindre un rendement de 54 % avant de prendre en compte les autres pertes d'énergie. Ce rendement est environ 2 à 2,5 fois plus élevé que celui d'un véhicule à essence typique.
Ces types de véhicules font l'objet de nombreuses critiques, car beaucoup affirment que le coût de ces véhicules ne sera jamais réaliste. Le platine contenu dans les piles à combustible les a rendues chères, mais les progrès réalisés permettent de faire baisser les prix.[1] La durabilité et la performance de ces systèmes, ainsi que l'infrastructure nécessaire pour les accueillir, sont également examinées de près.
En savoir plus
- Rendement thermique
- Hydrogène
- Véhicule à carburant alternatif
- Hydrogène comme devise énergétique
- Ou explorez une page au hasard
Références
- ↑ 1,0 1,1 1,2 1,3 et 1,4 How Stuff Works. (August 10, 2015). How Fuel Cells Work [Online], Available: http://auto.howstuffworks.com/fuel-efficiency/alternative-fuels/fuel-cell.htm
- ↑ Wikimedia Commons [Online], Available: https://commons.wikimedia.org/wiki/File:Solid_oxide_fuel_cell.svg#/media/File:Solid_oxide_fuel_cell.svg
- ↑ Wikimedia Commons [Online], Available: https://commons.wikimedia.org/wiki/File:PEM_fuel_cell.svg
- ↑ O'Hayre, Ryan, et al. Fuel Cell Fundamentals, John Wiley & Sons, Incorporated, 2016.
- ↑ I. Hore-Lacy, "Future Energy Demand and Supply," in Nuclear Energy in the 21st Century, 2nd ed., London, UK: WNUP, 2011, ch.1, sec.6, pp.9
- ↑ G. Aubrecht. "Fuel Cells," in Energy: Physical, Environmental, and Social Impact, 3rd ed. San Francisco, CA, U.S.A.: Pearson, 2006, pp. 98-99
- ↑ I. Hore-Lacy, "Hydrogen Production and Use," in Nuclear Energy in the 21st Century, 2nd ed., London, UK: WNUP, 2011, ch.7, sec.2, pp.75-78
- ↑ Wikimedia Commons. "Fuelcell" by Welleman, [Online], Available: https://commons.wikimedia.org/wiki/File:Fuelcell.jpg#/media/File:Fuelcell.jpg
- ↑ R. Wolfson, "Toward a Hydrogen Economy?" in Energy, Environment, and Climate, 2nd ed., New York, NY: W.W. Norton & Company, 2012, ch. 11, sec. 2, pp. 307-315