Pluie acide
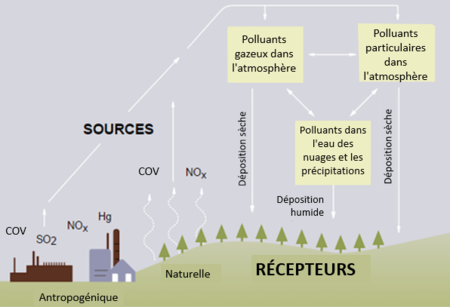
Le dépôt acide est tout type de précipitation - pluie, neige, grésil, grêle ou brouillard - dont le pH est inférieur à la normale (et donc plus acide). Cependant, le terme presque toujours utilisé pour tous ces phénomènes est la pluie acide. Cette acidité plus élevée peut causer des problèmes dans les écosystèmes et l'environnement, et reste l'un des principaux problèmes environnementaux liés à l'utilisation des combustibles, malgré les tentatives faites depuis les années 1970 pour résoudre ce problème.[2]
Les pluies acides sont produites lorsque l'eau de l'air se combine avec les oxydes d'azote et les dioxydes de soufre, deux types de polluants, et retombe ensuite à la surface de la Terre. Ces polluants peuvent également s'accumuler à la surface de la Terre et la pluie peut se combiner avec eux à leur arrivée sur la Terre, c'est pourquoi le terme « dépôt acide » est souvent préféré à celui de pluie acide.[2]
Acidité
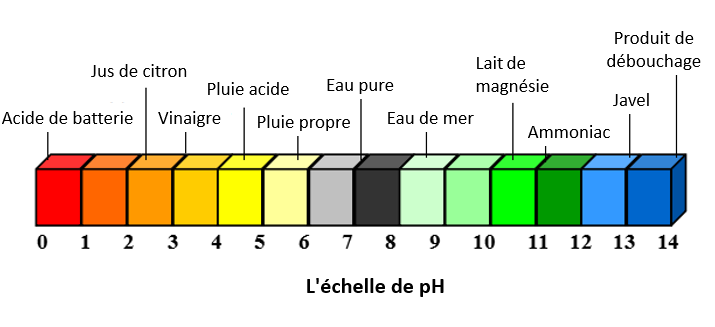
La pluie normale a un pH d'environ 5,6, elle est donc légèrement acide. Ceci est dû à la combinaison du dioxyde de carbone avec l'eau présente dans l'air pour former de l'acide carbonique [3]. Cette acidité est naturellement neutralisée lorsque les précipitations entrent en contact avec des minéraux alcaline tels que le calcium, le magnésium et le potassium présents dans les roches à la surface de la Terre. Ce processus de neutralisation de l'acidité est à l'origine de la météorisation chimique des roches et est responsable de la libération de bicarbonates dans le sol et les systèmes d'eau, qui agissent alors comme des tampons contre les apports acides plus forts.[2] Les pluies acides, en revanche, ont un pH d'environ 4,2. Cela signifie que les pluies acides sont environ 25 fois plus acides que les pluies normales, en raison de la nature logarithmique de l'échelle de pH.
Impacts
Les pluies acides ont de nombreux effets néfastes sur la végétation, les écosystèmes d'eau douce et les structures naturelles et artificielles. Elles peuvent également provoquer des maladies respiratoires chez les êtres humains, en particulier chez ceux qui présentent des maladies préexistantes.[5] Lorsque les lacs et autres masses d'eau deviennent trop acides, généralement avec un pH inférieur à 6,0, les plantes et la vie aquatique commencent à souffrir.[2] La capacité de reproduction des poissons diminue, la mort ou la difformité étant très répandue chez les jeunes poissons. Les amphibiens et les invertébrés souffrent de la même manière, ce qui signifie que les lacs acides ont une vie animale très réduite, voire inexistante.[6]
Les impacts les plus notables ont été mesurés dans les sections nord-est de l'Amérique du Nord et de l'Europe occidentale, les sources d'acidification étant principalement attribuées aux centrales électriques au charbon qui émettent de grandes quantités de NOx et de SO2.[7] L'acidité des précipitations peut être observée à la figure 3 aux États-Unis, et en raison de la combinaison des flux de vent en provenance des États-Unis et de la production de polluants au Canada, l'Est du Canada souffre également de pluies acides.[8]. Diverses réglementations et restrictions concernant les polluants ont été mises en place pour résoudre ce problème, et ces centrales doivent utiliser des dispositifs de contrôle de la pollution atmosphérique pour les respecter.
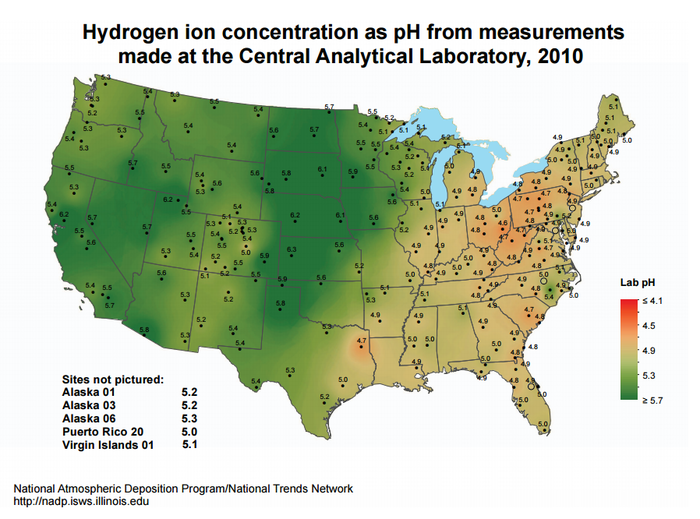
Lorsque les pluies acides tombent sur la Terre, leurs effets dépendent du type de roche et de sol qu'elles rencontrent. Le calcaire est capable de neutraliser l'acide contenu dans la pluie, tandis que le substratum granitique, composé de granite, de quartz et de gneiss, ne peut pas le faire aussi facilement.[8]. Le substratum rocheux des régions nord-est de la figure 2 est dominé par ces types de roches granitiques et n'est recouvert que par de fines strates de sol, ce qui signifie que la neutralisation des précipitations acides est lente ou inexistante.[7] Les lacs situés à des altitudes plus élevées dans ces régions ont tendance à être plus acides, et sont considérés comme « morts » s'ils ne sont pas capables de soutenir la vie.
L'accumulation de neige acide sur les montagnes est également une conséquence négative, d'autant plus qu'une grande partie du contenu acide peut être libérée en une seule fois au printemps dans le ruissellement des montagnes. Ce choc chimique est dévastateur pour la vie végétale en aval.[7]De nombreux lacs de montagne ont perdu leurs populations de poissons en raison de l'augmentation de l'acidité due au ruissellement de la fonte des neiges.[8]

Drainage rocheux acide
Si les précipitations tombent sur des roches qui contiennent des minéraux soufrés tels que la pyrite ou la galène, la combinaison du métabolisme des micro-organismes et de l'atmosphère oxydante peut conduire à des ruissellements dont le pH est inférieur à trois, ce qui est plus de 100 fois plus acide que les précipitations traditionnelles.[11]. Ce type de ruissellement acide se trouve généralement sur les anciens sites miniers abandonnés où des minéraux sulfureux ont été exploités à des fins industrielles et économiques. En conséquence, ce type de dépôt acide est parfois appelé drainage minier acide. Lorsque le pH de ces eaux de ruissellement s'élève au-dessus de trois et que le ruissellement est lentement neutralisé par les carbonates présents dans l'environnement, le fer précédemment dissous précipite sous forme de composés d'oxyde de fer. Cela donne aux eaux une coloration jaune-orange caractéristique connue sous le nom de « garçon jaune ».
Prévention
Après avoir pris conscience des impacts des pluies acides, de nombreux programmes de réduction de la pollution ont été mis en place dans le monde depuis les années 1980.[12]. Les émissions de SO2 ont diminué de 40 % aux États-Unis, les niveaux de pluies acides ayant baissé d'environ 65 % en 2005. Il en est de même pour le NOx.[13] Cela est possible grâce à l'utilisation de dispositifs de contrôle de la pollution atmosphérique, tels que les épurateurs et les précipitateurs électrostatiques. Les centrales électriques au charbon et d'autres installations industrielles ont besoin de ces dispositifs pour respecter les restrictions sur les émissions, et peuvent réduire les émissions de certains polluants nocifs de 99 %[13].
En savoir plus
- Acide
- Base
- L'échelle de pH
- Chimique
- Eau
- Cycle de l'eau
- Ou explorez une page au hasard
Références
- ↑ Wikimedia Commons [Online], AVailable: https://upload.wikimedia.org/wikipedia/commons/b/b1/Origins_of_acid_rain.svg
- ↑ 2,0 2,1 2,2 et 2,3 Pollution Probe. The Acid Rain Primer. Visit www.pollutionprobe.org
- ↑ USEPA (May 30, 2020). Acid Rain Students Site [Online]. Accessible: https://www3.epa.gov/acidrain/education/site_students/phscale.html
- ↑ Adapted from Energy: Its use and the Environment. See Reference 8
- ↑ B. Everett, G. Boyle, S. Peake and J. Ramage, "Penalties: Assessing the Environmental and Health Impacts of Energy Use," in Energy Systems and Sustainability, 2nd ed., Oxford, UK: Oxford, 2013, ch.13, pp.543
- ↑ R. Wolfson, "Air Pollution" in Energy, Environment, and Climate, 2nd ed., New York, NY: W.W. Norton & Company, 2012, ch. 6, sec. 2, pp. 129-142
- ↑ 7,0 7,1 et 7,2 J. Kraushaar and R. Ristinen, "Acid Rain," in Energy and Problems of a Technical Society, 2nd ed., Hoboken, NJ: Wiley, 1993, ch.14, sec.6, pp.404-407
- ↑ 8,0 8,1 et 8,2 Environment and Climate Change Canada (May 31, 2020). "Acid Rain FAQ" [Online]. Accessible: https://www.ec.gc.ca/air/default.asp?lang=En&n=7E5E9F00-1
- ↑ EPA. Acid Rain in New England [Online], Available: http://www.epa.gov/region1/eco/acidrain/intro.html
- ↑ Wikimedia Commons (June 1, 2020). [Online]. Accessible: https://commons.wikimedia.org/wiki/File:PA_AcidMineDrainage.jpg
- ↑ Warren, L.A. (2011). "Acid Rock Drainage". In: Reitner J., Thiel V. (eds) Encyclopedia of Geobiology. Encyclopedia of Earth Sciences Series. Springer, Dordrecht. [Online]. Accessible: https://link.springer.com/referenceworkentry/10.1007%2F978-1-4020-9212-1_3
- ↑ Nunez, Christina (June 1st, 2020). "Acid Rain, Explained" [Onine]. Accessible: https://www.nationalgeographic.com/environment/global-warming/acid-rain/
- ↑ 13,0 et 13,1 R. A. Hinrichs and M. Kleinbach, "Acid Rain," in Energy: Its Use and the Environment, 5th ed. Toronto, Ont. Canada: Brooks/Cole, 2006, ch.8, sec.C, pp.252-256

