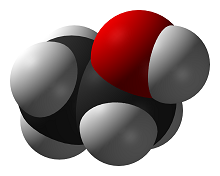
Éthanol
En termes de chimie, l'éthanol est un alcool, également appelé alcool éthylique ou alcool de bouche. Comme le montre la figure 1, l'éthanol a la formule chimique [math]\ce{ C2H5OH }[/math]. L'éthanol peut être utilisé comme carburant puisqu'il peut produire de l'énergie chaleur à la suite de la combustion de l'alcool.
L'éthanol est un liquide clair et incolore dont l'odeur est qualifiée d'odeur caractéristique de l'alcool.[2] L'éthanol est principalement utilisé comme solvant dans la fabrication de vernis et de parfums et comme conservateur pour les spécimens biologiques. En outre, l'éthanol est utilisé comme désinfectant et peut également être consommé comme boisson.[3] L'éthanol dérivé de la biomasse (bioéthanol) est un additif pour l'essence ou un carburant alternatif.
Production
La plupart de l'éthanol est généralement produit de l'une des deux manières suivantes : à partir du pétrole ou de la biomasse. L'éthanol dérivé du pétrole est produit dans de grandes usines chimiques par un processus pétrochimique.[4] Les matières premières sont séparées du pétrole par distillation fractionnée. L'éthane ([math]\ce{ C2H6 }[/math]), l'une des matières premières séparées, subit un craquage pour devenir de l'éthène ([math]\ce{ C2H4 }[/math]), également appelé éthylène. L'éthène est converti en éthanol par un processus d'hydratation qui nécessite un catalyseur (souvent de l'acide phosphorique) tandis que le réactif éthène est sous vapeur à haute pression dans la chambre de réaction.[4] Une pression élevée augmente la vitesse de réaction, de sorte qu'une plus grande quantité d'éthanol sera produite. Ce processus d'hydratation entraîne la réaction exothermique suivante qui libère de l'énergie (en forme de chaleur) :
L'éthanol produit à partir de la biomasse est connu sous le nom de bioéthanol, et ce processus est expliqué sur la page consacrée au bioéthanol.
Propriétés
Le tableau ci-dessous présente certaines propriétés fondamentales de l'éthanol.
| Formule | C2H6O |
| Masse molaire | 46.07 grammes/mole |
| Densité énergétique | 29.7 MJ/kg[5] |
| Point de fusion | -114.1oC[2] |
| Point d'ébullition | 78.2oC[2] |
Réaction de combustion
Ethanol is used as a combustible fuel. L'animation ci-dessous montre la réaction nette qui se produit lors de la combustion de l'éthanol. Il convient de noter que l'éthanol a besoin d'oxygène pour subir une combustion. Alors que le CO2 sera finalement absorbé par la matière végétale, ce n'est pas immédiat, voir temps de résidence du dioxyde de carbone dans l'atmosphère.
La réaction de combustion d'alcool libère de l'énergie thermique et est un exemple de réaction exothermique. La réaction présente également une valeur négative de changement d'enthalpie (ΔH).
En savoir plus
- Énergie chimique
- Liaison chimique
- Combustion
- Énergie primaire
- Technologie de conversion de l'énergie
- Ou explorez une page au hasard.
Références
- ↑ "Ethanol-3D-vdW" Licensed under Public Domain via Wikimedia Commons - http://commons.wikimedia.org/wiki/File:Ethanol-3D-vdW.png#mediaviewer/File:Ethanol-3D-vdW.png
- ↑ 2,0 2,1 et 2,2 National Center for Biotechnology Information. (2015). Properties of Ethanol [Online]. Available: http://pubchem.ncbi.nlm.nih.gov/compound/ethanol#section=Top [February 16,2015].
- ↑ National Center for Biotechnology Information. PubChem Database. Ethanol, CID=702, https://pubchem.ncbi.nlm.nih.gov/compound/Ethanol (accessed on Jan. 19, 2020)
- ↑ 4,0 et 4,1 Greener-industry.org.uk. (2020). Greener Industry - Ethanol - Production Method 1. [online] Available at: http://www.greener-industry.org.uk/pages/ethanol/ethanol6PM1.htm [Accessed 25 Jan. 2020].
- ↑ Glenn Elert. (2015). The Physics Hypertextbook - Chemical Potential Energy [Online]. Available: http://physics.info/energy-chemical/ [February 16, 2015].