Échelle de pH
Le terme pH est une abréviation de pouvoir de l'hydrogène, qui est une mesure de l'acidité ou de la basicité d'une solution chimique. La plupart des solutions sont soit acides soit basiques (également appelées alcalines) - une substance qui n'est ni acide ni basique est neutre.[2]
Les acides et les bases sont très importants du point de vue chimique et on les trouve presque partout. Un exemple dans le contexte de l'énergie est celui des pluies acides, qui se forment lorsque l'eau interagit avec divers polluants dans l'atmosphère. Les polluants dissous dans l'eau de pluie la rendent acidifiée, ce qui peut causer des dommages à l'environnement et aux structures artificielles. Pour en savoir plus sur les pluies acides, voir ici.
L'échelle de pH
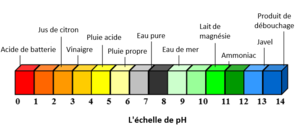
Une valeur de pH est utilisée pour décrire une solution à base d'eau. En général, une petite valeur de pH décrit une solution qui est acide, et une plus grande valeur de pH décrit des solutions qui sont moins acides (plus basiques). L'échelle du pH est centrée sur 7 - ce qui signifie qu'une solution dont le pH est de 7 est parfaitement neutre (ni acide ni basique). La figure 1 présente quelques exemples de substances courantes et leur place sur l'échelle de pH.
La valeur du pH d'une solution mesure directement la concentration des ions d'hydrogène (H+) dans la solution. Les acides ont une grande concentration de H+, ce qui se traduit par une petite valeur de pH. Les bases ont une très faible H+. Les solutions basiques ont des valeurs de pH élevées - supérieures à pH 7.
Alors que les valeurs de pH ont été mesurées aussi bas que -3,6[3] et jusqu'à 17,6 [4], la plupart des solutions rencontrées dans la nature ont un pH 0 à pH 14.
Le pH est une échelle logarithmique. Cela signifie que pour chaque changement d'un chiffre du pH, l'acidité (concentration H+) change par 10 fois. Par exemple, une solution dont le pH est de 4 a 10 fois plus de H+ qu'une solution dont le pH est de 5. Une solution de pH 3 aura 100 fois plus de H+ (elle est 100 fois plus acide) qu'une solution de pH 5.
Ions d'hydroxyde et d'hydrogène
Étant donné que le pH est mesuré dans des solutions aqueuses, il y a toujours un équilibre entre H+ (ions d'hydrogène) et OH – (ions d'hydroxyde). C'est parce que l'eau peut se décomposer en ces deux ions :
À température ambiante, l'équilibre entre les H+ et OH– dans l'eau sont liées par l'expression suivante ([H+] signifie concentration de H+):
Cette équation montre que plus une solution contient d'ions hydrogène, moins elle doit contenir d'ions hydroxyde. Ainsi, une solution acide qui contient une grande quantité de H+ aura très peu OH–. Et une solution de base qui a très peu H+ aura plus de OH–. Une solution qui est exactement neutre aura la même quantité de H+ et OH–.
Calculer le pH
Pour calculer le pH, vous devez connaître la concentration d'ions hydrogène (H+) dans votre solution. A partir de là, le pH peut être trouvé par :
Comme il s'agit d'un calcul logarithmique, pour modifier le pH d'une unité (par exemple, de 2 à 3), la concentration de H+ doit être modifiée de 10 fois (par exemple, de 0,01 mol/L à 0,001 mol/L).
Découvrir plus
La simulation PhET ci-dessous a été gracieusement fournie par l'Université du Colorado. Cette simulation peut aider à explorer comment le pH change lorsque des liquides se mélangent.
En savoir plus
- Acide
- Base
- Chimique
- Eau
- Pluies acides
- Cycle de l'eau
- Ou explorez une page au hasard
Pour explorer le pH en profondeur, veuillez consulter le Chemistry LibreTexts.
Références
- ↑ Wikimedia Commons [Online], Available: https://upload.wikimedia.org/wikipedia/commons/2/23/216_pH_Scale-01.jpg
- ↑ US EPA. (July 8, 2015). What is pH? [Online], Available: http://www.epa.gov/acidrain/measure/ph.html
- ↑ Nordstrom and Alpers, Negative pH, efflorescent mineralogy, and consequences for environmental restoration at the Iron Mountain Superfund site, California Proc Natl Acad Sci U S A, vol. 96, no. 7, pp 3455-3462, 1999 [Online], Available: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC34288/
- ↑ Licht, "pH Measurement in Concentrated Alkaline Solutions" Anal. Chem., vol. 57, pp. 514-519, 1985 [Online], Available, http://pubs.acs.org.ezproxy.lib.ucalgary.ca/doi/pdf/10.1021/ac50001a045

