Désintégration alpha
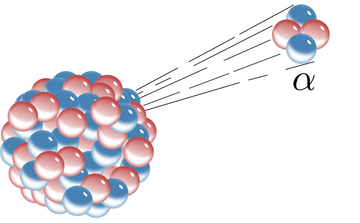
La désintégration alpha est un processus de désintégration nucléaire dans lequel un noyau instable se transforme en un autre élément par l'émission d'une particule composée de deux protons et de deux neutrons.[2] Cette particule éjectée est connue sous le nom de particule alpha et est simplement un noyau d'hélium. Les particules alpha ont une masse relativement importante et une charge positive. Cette grande masse signifie que les particules alpha ne peuvent pas aller très loin dans l'air, ou pénétrer très profondément dans un solide. Les particules alpha n'affectent que les surfaces, c'est pourquoi la désintégration alpha est rarement utilisée en thérapie externe par rayonnement médical.[3]
La désintégration alpha a été initialement distinguée des autres formes de rayonnement par Ernest Rutherford en observant la déviation du rayonnement à travers un champ magnétique. Les particules alpha ont une charge [math]\displaystyle{ +2e }[/math] et dévient dans un champ magnétique selon cette charge.[4]
L'équation générale représentant la désintégration alpha est :
where:
- [math]\displaystyle{ ^A_ZX }[/math] Est le noyau parent, le noyau de départ.
- [math]\displaystyle{ A }[/math] C'est le nombre total de nucléons (le nombre de neutrons plus le nombre de protons).
- [math]\displaystyle{ Z }[/math] Est le nombre total de protons.
- [math]\displaystyle{ ^{A-4}_{Z-2}Y }[/math] est le noyau fille, le noyau terminal
- [math]\displaystyle{ ^4_2He }[/math] est la particule alpha libérée
Sécurité
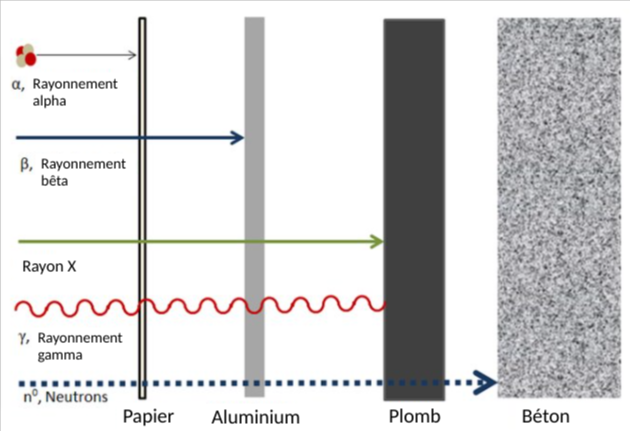
Même si elle est peu pénétrante, l'ingestion d'une substance qui subit une désintégration alpha est nocive car les particules alpha éjectées peuvent endommager très facilement les tissus internes malgré sa faible portée. Ces dommages résultent du contact avec les membranes et les cellules vivantes.[3] La figure 2 présente un diagramme qui illustre les différents niveaux de pénétration pour différents types de rayonnement.
En général, les effets des particules alpha sur la santé varient en fonction de la manière dont l'exposition a lieu. Si l'émetteur alpha est inhalé, avalé ou absorbé dans la circulation sanguine, il peut y avoir des dommages biologiques chroniques. Ces dommages augmentent le risque de cancer chez une personne. Le rayonnement alpha est connu pour provoquer le cancer du poumon chez l'homme si l'émetteur alpha est inhalé. L'inhalation de radon, un émetteur alpha, est l'une des principales sources de maladies liées à la désintégration alpha chez l'homme.[7]
Applications et importance

Les éléments radioactifs qui subissent une désintégration alpha sont utilisés dans les détecteurs de fumée (voir figure 3). L'américium est un élément fréquemment utilisé car il constitue une source importante de particules alpha. À l'intérieur du détecteur de fumée, des particules alpha sont libérées. Ceci à son tour ionise l'air à l'intérieur du détecteur. La fumée présente dans le détecteur absorbe ce rayonnement alpha. Ainsi, en présence de fumée, l'ionisation est modifiée et l'alarme se déclenche.[9]
De même, les particules alpha sont utilisées dans un processus connu sous le nom de spectroscopie X-ray des particules alpha (APXS). Ce procédé est utilisé pour déterminer la composition élémentaire des roches et des sols. La NASA a utilisé cette méthode lors de ses missions sur Mars, notamment les missions Pathfinder, pour déterminer les éléments présents dans les roches martiennes.[10]
Les particules alpha ont également une certaine utilité dans le domaine médical. Un nouveau traitement du cancer connu sous le nom de thérapie alpha ciblée ou TAT utilise la désintégration alpha pour tuer les cellules cancéreuses. Le plomb-212 est ingéré et se déplace jusqu'au site de la tumeur, puis émet un rayonnement alpha qui tue toutes les cellules de la région.[10]
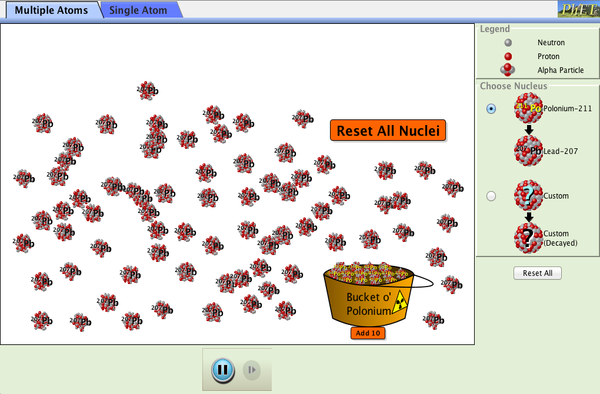
PhET
L'Université du Colorado nous a gracieusement autorisés à utiliser la simulation PhET suivante. Cette simulation illustre la désintégration des noyaux radioactifs par désintégration alpha et montre la demi-vie de ces atomes.
En savoir plus
Pour de plus amples informations, veuillez consulter les pages connexes ci-dessous :
- Demi-vie
- Désintégration bêta
- Désintégration gamma
- Interaction nucléaire forte
- ou explorez une page au hasard !
Références
- ↑ Wikimedia Commons. (July 22, 2015). Alpha Decay [Online]. Available: https://upload.wikimedia.org/wikipedia/commons/thumb/7/79/Alpha_Decay.svg/1280px-Alpha_Decay.svg.png
- ↑ Jefferson Lab. (July 22, 2015). Alpha Decay [Online]. Available: http://education.jlab.org/glossary/alphadecay.html
- ↑ 3,0 et 3,1 HyperPhysics. (July 22, 2015). Alpha Radioactivity [Online]. Available: http://hyperphysics.phy-astr.gsu.edu/hbase/nuclear/radact.html#c2
- ↑ StudyPhysics. (July 22, 2015). Alpha, Beta, and Gamma Decay [Online]. Available: http://www.studyphysics.ca/2007/30/08_atomic/43_decay.pdf
- ↑ Chubu Electric Power. (May 26, 2015). Characteristics of radiation and radioactivity [Online]. Available: http://hamaoka.chuden.jp/english/radioactivity/aspect.html
- ↑ Created internally by a member of the Energy Educaation team.
- ↑ US EPA. (July 22, 2015). Alpha Particles [Online]. Available: http://www.epa.gov/radiation/understand/alpha.html#properties
- ↑ By MD111 (https://www.flickr.com/photos/md111/3266158320/) [CC BY-SA 2.0 (https://creativecommons.org/licenses/by-sa/2.0)], via Wikimedia Commons (Accessed May 8th, 2018.) from https://upload.wikimedia.org/wikipedia/commons/2/23/InsideSmokeDetector.jpg
- ↑ BBC Bitesized. (July 22, 2015). Uses of Radiation [Online]. Available: http://www.bbc.co.uk/schools/gcsebitesize/science/ocr_gateway_pre_2011/living_future/4_nuclear_radiation2.shtml
- ↑ 10,0 et 10,1 ChemTeacher. (July 22, 2015). Alpha Decay [Online]. Available: http://chemteacher.chemeddl.org/services/chemteacher/index.php?option=com_content&view=article&id=65