« Alcène » : différence entre les versions
m (1 version importée) |
energy_fr>Ethan.boechler Aucun résumé des modifications |
||
| Ligne 1 : | Ligne 1 : | ||
[[Category:Finit]] | [[Category:Finit]] | ||
[[en:Alkene]] | [[en:Alkene]] | ||
<onlyinclude>Un '''alcène''' est l'un des quatre types principaux d'[[hydrocarbure]]s. Les alcènes sont caractérisés par la présence d’une | <onlyinclude>Un '''alcène''' est l'un des quatre types principaux d'[[hydrocarbure]]s. Les alcènes sont caractérisés par la présence d’une double liaison carbone-carbone dans leur chaîne carbonée. Les alcènes sont de vrais hydrocarbures, ce qui veut dire qu'ils ne sont constitués que d'[[hydrogène]] et de [[carbone]].<ref>“Alkenes,” Chemistry LibreTexts, 28-Nov-2016. [Online]. Available: http://chemwiki.ucdavis.edu/Organic_Chemistry/Hydrocarbons/Alkenes. [Accessed: 19-May-2017].</ref></onlyinclude> | ||
Les alcènes possèdent la formule moléculaire C<sub>'''''n''''' </sub>H<sub>2'''''n'''''</sub> où | Les alcènes possèdent la formule moléculaire C<sub>'''''n''''' </sub>H<sub>2'''''n'''''</sub> où | ||
| Ligne 9 : | Ligne 9 : | ||
*'''''n''''' désigne le nombre d'[[atome]]s de carbone. | *'''''n''''' désigne le nombre d'[[atome]]s de carbone. | ||
Les | Les alcènes sont similaires aux alcanes, sauf qu'ils contiennent une double liaison entre deux atomes de carbone plutôt qu'une seul liaison. Lorsqu'un carbone partage une double liaison avec un autre, cela limite le nombre d'atomes d'hydrogène qui peuvent être liés (par conséquent, il y aura moins d'atomes d'hydrogène par atome de carbone). | ||
Les deux alcènes les plus simples sont l'[[éthène]] (C<sub>2</sub>H<sub>4</sub>) et le [[propène]] (C<sub>3</sub>H<sub>6</sub>). | Les deux alcènes les plus simples sont l'[[éthène]] (C<sub>2</sub>H<sub>4</sub>) et le [[propène]] (C<sub>3</sub>H<sub>6</sub>). | ||
| Ligne 28 : | Ligne 28 : | ||
==En savoir plus== | ==En savoir plus== | ||
*[[Alcane]] | *[[Alcane]] | ||
*[[ | *[[Alcyne]] | ||
*[[Hydrocarbure]] | *[[Hydrocarbure]] | ||
*Ou explorez une [[Spécial: Au hasard | page au hasard]]. | *Ou explorez une [[Spécial: Au hasard | page au hasard]]. | ||
Version du 13 janvier 2023 à 18:48
Un alcène est l'un des quatre types principaux d'hydrocarbures. Les alcènes sont caractérisés par la présence d’une double liaison carbone-carbone dans leur chaîne carbonée. Les alcènes sont de vrais hydrocarbures, ce qui veut dire qu'ils ne sont constitués que d'hydrogène et de carbone.[1]
Les alcènes possèdent la formule moléculaire Cn H2n où
Les alcènes sont similaires aux alcanes, sauf qu'ils contiennent une double liaison entre deux atomes de carbone plutôt qu'une seul liaison. Lorsqu'un carbone partage une double liaison avec un autre, cela limite le nombre d'atomes d'hydrogène qui peuvent être liés (par conséquent, il y aura moins d'atomes d'hydrogène par atome de carbone).
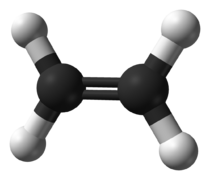
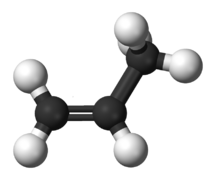
Les deux alcènes les plus simples sont l'éthène (C2H4) et le propène (C3H6).
- Modèle moléculaire boules-bâtonnets des deux alcènes les plus simples
Figure 1. Éthène.[2]
Figure 2. Propène.[3]
Les alcanes peuvent être reconnus par leur suffixe -ène.
Lorsqu'il y a plus de quatre atomes de carbone par chaîne d'alcène, la position de la double liaison peut créer diverses structures possibles et utiliser une nomenclature plus précise. Les composés qui ont la même formule chimique mais des dispositions de liaison différentes sont appelés isomères structuraux.
Dans l'industrie, le terme oléfine est souvent utilisé comme synonyme généralisé de l'alcène. Une oléfine est tout hydrocarbure contenant une ou plusieurs doubles liaisons. Citons, par exemple, le polypropylène, qui est utilisé dans l'industrie des plastiques.[4]
Pour en savoir plus sur les alcènes, cliquez ici
En savoir plus
- Alcane
- Alcyne
- Hydrocarbure
- Ou explorez une page au hasard.
Références
- ↑ “Alkenes,” Chemistry LibreTexts, 28-Nov-2016. [Online]. Available: http://chemwiki.ucdavis.edu/Organic_Chemistry/Hydrocarbons/Alkenes. [Accessed: 19-May-2017].
- ↑ https://commons.wikimedia.org/wiki/File:Ethylene-CRC-MW-3D-balls.png
- ↑ https://commons.wikimedia.org/wiki/File:Propylene-3D-balls.png
- ↑ “Alkene,” Wikipedia, 2021. [Online]. Available: https://en.wikipedia.org/wiki/Alkene. [Accessed: 07-May-2021].