Isótopo
El número de protones en el núcleo de un átomo establece cómo reaccionará químicamente el átomo. En otras palabras, el número de protones determina el elemento. Los isótopos de un elemento son átomos con el mismo número de protones, pero con un número diferente de neutrones. Al cambiar el número de neutrones de un átomo, se cambia su masa atómica.[2]
Toda la materia está formada por átomos en diversas disposiciones. Los átomos tienen protones y neutrones en un núcleo denso en el centro, y electrones en orbitales alrededor del núcleo. Cada protón tiene una carga de +1, cada electrón una carga de -1, los neutrones no tienen carga (carga neutra--neutrón). Los átomos del mismo elemento tienen todos el mismo número de protones, por definición, porque los elementos se definen por el número de protones que tienen. Tener un número diferente de neutrones en el núcleo no afecta a la carga del átomo. En cambio, los diferentes isótopos tienen diferente masa y tienen diferentes tendencias a la desintegración radioactiva, o a cambiar con el tiempo.
Los diferentes isótopos tienen propiedades químicas muy similares porque la química está determinada por la carga eléctrica. Esto hace que la separación química de los isótopos sea muy difícil. Por ejemplo, el hidrógeno sólo tiene un protón. Hay tres isótopos de hidrógeno en la naturaleza. El más común de estos isótopos tiene un protón y ningún neutrón y se llama protonio. La siguiente forma más común, con un protón y un neutrón, se llama deuterio. La forma radioactiva del hidrógeno que se encuentra en la naturaleza tiene un protón y dos neutrones y se llama tritio. Obsérvese que las tres formas de hidrógeno tienen un solo protón; eso es lo que lo hace el hidrógeno. Como resultado de estas diferencias, existen algunas diferencias químicas muy sutiles. Por ejemplo, el punto de ebullición del agua con deuterio (100.7 °C) es un poco más alto que el punto de ebullición del agua con sólo protonio (100 °C). Esta pequeña diferencia es más pronunciada en el hidrógeno que en los elementos más pesados.
Los isótopos pueden ser estables o inestables. Los isótopos inestables son los que sufren desintegración radioactiva y, en el proceso, se transforman en otros elementos. Algunos isótopos inestables tienen vidas medias muy cortas (menos de un nanosegundo), mientras que otros tienen vidas medias extremadamente largas (billones de años). Los isótopos estables no decaen con el paso del tiempo y suelen ser los más comunes de cualquier elemento.
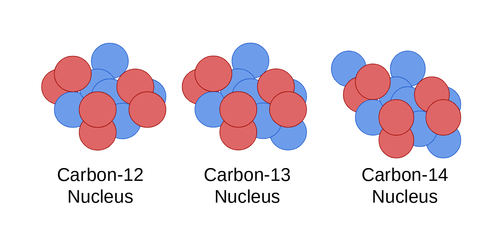
Un ejemplo para ilustrar este punto serían los diferentes isótopos del carbono. Los isótopos más comunes del carbono son el carbono-12, el carbono-13 y el carbono-14, a menudo escritos como 12C, 13C y 14C. Estos tipos de átomos tienen 6, 7 y 8 neutrones, respectivamente. El 12C es el isótopo de carbono más común en la naturaleza. El 14C es famoso por su uso en la datación radiactiva arqueológica, utilizando su vida media.[3] (Véase Hyperphysics para más información sobre la datación por carbono).
En la mayoría de los tipos de producción de energía nuclear, se utiliza un isótopo específico del uranio, el 235U. Este es el único núcleo fisible natural que se encuentra en la tierra (aunque se han fabricado otros isótopos fisibles de plutonio). En la naturaleza, el uranio existe como una mezcla de 238U, 235U y 234U. El 238U es, con mucho, el más frecuente.[4] El uranio utilizado para la energía nuclear en la mayoría de los reactores nucleares se procesa para que tenga una relación de 235U con respecto a los otros isótopos mayor que la que se da normalmente en la naturaleza. Este proceso se llama "enriquecimiento" del uranio[5] y es un trabajo de ingeniería muy difícil.
Consulte el GIF de al lado para ver cómo traducir los subtítulos de YouTube.
Phet: Construye un núcleo
El equipo de Energy Education ha adaptado la siguiente simulación de la Universidad de Colorado. Esta simulación muestra cómo los neutrones y protones se sitúan en los niveles energéticos y conforman el núcleo. El número de neutrones y protones mantiene unas proporciones determinadas para que el núcleo sea estable. Cambiando el número de neutrones en el núcleo, mientras se mantiene el mismo número de protones, cambia el isótopo.
Ver lecturas adicionales
Para conocer los otros núcleos, consulte las siguientes páginas:
- Isótopos para la sociedad
- Fuerza nuclear débil
- Fuerza nuclear fuerte
- Isótono
- Isómero nuclear
- Isóbaro (nuclear)
- O explore una página al azar
Referencias
- ↑ 1,0 1,1 Creado internamente por un miembro del equipo de Energy Education.
- ↑ http://goldbook.iupac.org/I03331.html accessed Dec. 10th, 2014
- ↑ http://education.jlab.org/itselemental/iso006.html
- ↑ http://www.globalsecurity.org/wmd/intro/u-isotopes.htm
- ↑ http://www.nrc.gov/materials/fuel-cycle-fac/ur-enrichment.html

