Deuxième loi de la thermodynamique

La deuxième loi de la thermodynamique décrit les limites du transfert de chaleur. Surtout, elle énonce le principe que la chaleur ne peut pas être entièrement convertie en énergie mécanique. Cette idée importante peut être énoncée de nombreuses façons, mais trois seront examinées en détail. Ce sont :
Déclaration de chaleur résiduelle
La déclaration sur la chaleur résiduelle, connue officiellement sous le nom de « déclaration de Kelvin-Planck », est la suivante :[2]
C'est une déclaration de rendement thermique dans le transfert de chaleur, donnée par l'équation de la figure 2.
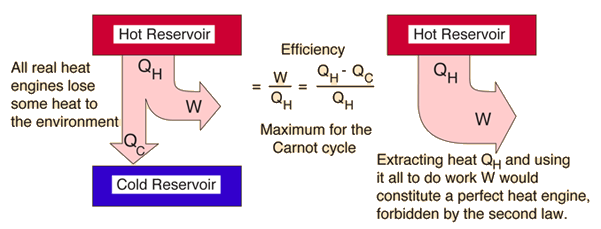
Cette affirmation est importante à comprendre en termes de fonctionnalité des moteurs thermiques. La chaleur résiduelle est nécessaire à tous les moteurs, et la quantité de travail fournie par l'apport de chaleur donne le rendement thermique d'un système. En utilisant une analyse de la chaleur et du travail sur un moteur idéal, la quantité maximale de travail qui peut être obtenue par un échange thermodynamique entre deux températures spécifiques est donnée par le rendement de Carnot. Bien que le rendement de Carnot ne puisse jamais être atteint dans la réalité, il est utile de s'y comparer lorsqu'on examine le rendement thermique d'un moteur.
Pour une étude plus détaillée de cette version de la deuxième loi, veuillez consulter la page « hyperphysics » sur la deuxième loi : moteurs thermiques.
Déclaration de réfrigération
Également connu sous le nom de « déclaration de Clausius », ce principe est fondamental pour le fonctionnement d'un système de réfrigération :
C'est ce que dit la déclaration de Clausius, qui explique pourquoi un glaçon fondra lorsqu'il sera placé dans un bol d'eau chaude, mais que la glace ne se formera pas à partir de l'eau en dehors par une journée chaude. L'expérience quotidienne confirme certainement cette idée, mais c'est un concept physique profond qui limite ce qui est possible avec l'énergie.
La deuxième loi de la thermodynamique affirme qu'il est impossible que la chaleur s'écoule spontanément d'un corps froid vers un corps chaud, mais qu'elle peut se déplacer de cette façon si un certain travail est effectué.[3] C'est ainsi que fonctionne le processus de réfrigération, dont on peut voir un exemple à la figure 1. Les réfrigérateurs fonctionnent en transférant la chaleur des régions froides à l'intérieur de l'appareil vers les régions chaudes à l'extérieur, rendant ainsi les régions froides encore plus froides. C'est ainsi que les réfrigérateurs gardent les aliments au frais, et que l'on peut sentir l'air chaud s'échapper de leurs bouches d'aération.[3]
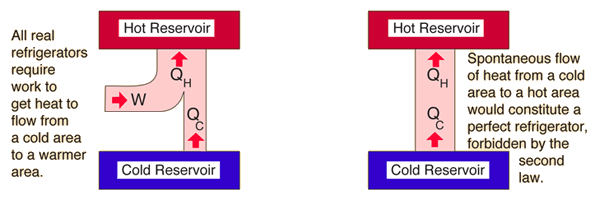
La partie droite des figures 2 et 3 décrit les scénarios impossibles que la deuxième loi interdit, ainsi un réfrigérateur parfait est équivalent à un transfert de chaleur d'un système fonctionnant à 100 % d'efficacité.
Dans la figure 3, le réfrigérateur prélève un peu de chaleur du réservoir froid, [math]\displaystyle{ Q_c }[/math], effectue un certain travail sur celui-ci, [math]\displaystyle{ W }[/math], et rejette un peu de chaleur [math]\displaystyle{ Q_H }[/math] vers le réservoir chaud. Par conséquent, l'effet net du réfrigérateur est de rendre le réservoir froid plus froid en enlevant de la chaleur et en la déplaçant vers le réservoir chaud. Pour cette raison, un réfrigérateur est essentiellement un moteur thermique qui fonctionne à l'envers. En analysant la capacité d'un réfrigérateur à refroidir le réservoir froid, les réfrigérateurs portent un coefficient de performance.
Cette affirmation est illustrée par la chanson humoristique « The First and Second Laws of Thermodynamics » de Flanders and Swann. Pour une description plus rigoureuse (mais moins drôle) de la déclaration de réfrigération de la deuxième loi, veuillez consulter la page hyperphysics.
Déclaration de désordre
Une autre déclaration, peut-être la plus cruciale pour comprendre pourquoi les déclarations de Clausius et de Kelvin-Planck sont vraies, concerne l'entropie ( qui peut être considéré comme un désordre ) :[4]
Il est important de souligner que cette affirmation se réfère à un « système fermé », ce qui signifie que le système n'est soumis à aucune influence extérieure. Cela est dû au fait qu'un système ouvert peut voir une diminution de son entropie. C'est grâce à cette capacité de diminuer l'entropie que les réfrigérateurs fonctionnent ! Cela dit, la Terre est un système ouvert car l'énergie solaire pour la Terre contribue aux flux d'énergie de la Terre.
L'entropie est essentiellement une mesure de « désordre », donc plus l'entropie est élevée, plus le système est désordonné. C'est ce que montre le mélange de briques dans une boîte : les briques ont plus de chances de former une pile désordonnée que de se transformer en une maison. Voir la page hyperphysics sur l'entropie pour une discussion plus détaillée.
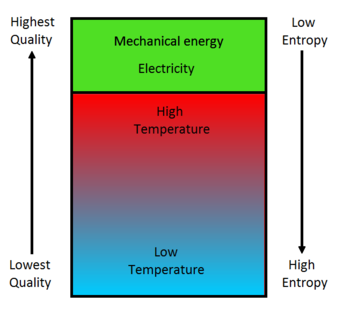
L'entropie est associée à l'idée de « qualité de l'énergie ». La chaleur est une énergie de faible qualité, tandis que l'énergie mécanique est une énergie de haute qualité. Comme le montre la figure 4, la qualité de l'énergie diminue lorsque l'entropie augmente. Par conséquent, puisque l'entropie augmente naturellement, la qualité de l'énergie se détériore. L'association entre une augmentation de l'entropie et une diminution de la qualité de l'énergie explique pourquoi toute l'énergie contenue dans les combustibles ne peut pas être convertie en énergie mécanique. Il est possible de brûler un combustible et donc de convertir directement toute son énergie en chaleur de faible qualité, mais cette chaleur de faible qualité ne peut ensuite être entièrement transformée en énergie mécanique de haute qualité ou en électricité.[4]
Pour une description plus détaillée de la déclaration d'entropie de la deuxième loi de la thermodynamique, veuillez consulter la page hyperphysics .
Références
- ↑ Wikimedia Commons [Online], Available: http://upload.wikimedia.org/wikipedia/commons/8/83/Kuehlregal_USA.jpg
- ↑ 2,0 et 2,1 Hyperphysics, Second Law of Thermodynamics [Online], Available: http://hyperphysics.phy-astr.gsu.edu/hbase/thermo/seclaw.html#c2
- ↑ 3,0 3,1 et 3,2 Hyperphysics, Refrigerator [Online], Available: http://hyperphysics.phy-astr.gsu.edu/hbase/thermo/seclaw.html#c3
- ↑ 4,0 4,1 et 4,2 R. Wolfson, "Entropy, Heat Engines, and the Second Law of Thermodynamics" in Energy, Environment, and Climate, 2nd ed., New York, NY: W.W. Norton & Company, 2012, ch. 4, sec. 7, pp. 81-84

