Oxygène

L'oxygène est le 8e élément du tableau périodique, et est le 3e élément le plus abondant dans l'Univers.[2]Bien que la quantité d'oxygène dans l'Univers soit dépassée par celle d'hydrogène et d'hélium, l'oxygène est l'élément le plus commun sur Terre et crucial pour la vie.[3]
L'oxygène existe sous deux formes élémentaires: l'oxygène moléculaire (O2) et l'ozone (O3). Il existe également dans d'innombrables composés avec d'autres éléments. Les composés d'oxygène sont appelés « oxydes ». Quelques exemples courants d'oxydes sont des minéraux tels que le granit et le quartz (les oxydes de silicium), la rouille (les oxydes de fer) et le calcaire (l'oxyde de calcium et de carbone). Plusieurs composés organiques contiennent également des atomes d'oxygène dans leur structure. Pour en savoir plus sur la chimie de l'oxygène, veuillez voir Chemistry LibreText.
Oxygène sur Terre

L'oxygène représente 46 % de la croûte terrestre, en grande partie sous forme de « silicates », des composés d'oxygène et de silicium. [5] L'oxygène comprend également environ 21 % de l' atmosphère sous forme d'oxygène moléculaire et d'ozone.
L'ozone (O3) est un polluant situé près de la surface terrestre, mais c'est est un élément vital de la stratosphère, car il forme la couche d'ozone - une couverture d'ozone qui protège la surface de la planète du rayonnement ultraviolet. L'ozone se forme naturellement dans l'atmosphère mais peut être détruit par la réaction avec certains polluants. Dans certaines régions, l'épuisement de l'ozone a créé un « trou dans la couche d'ozone » - un grave problème pour l'environnement.[6]
L'oxygène moléculaire (comme O2) est essentiel à la vie. De nombreux organismes ont besoin d'oxygène pour leur métabolisme, et les plantes photosynthétiques produisent de l'oxygène lorsqu'elles convertissent la lumière du Soleil en énergie stockée.
Oxygène et combustion
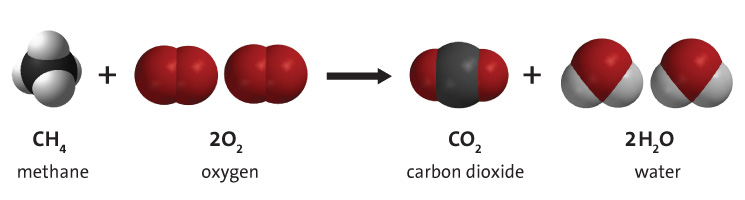
L'oxygène moléculaire est important pour la combustion - en particulier, de combustibles pour produire de l'énergie. La combustion est la réaction d'un composé avec un oxydant, généralement de l'oxygène moléculaire, pour produire des oxydes. La combustion de combustibles fossiles tels que le méthane, illustrée à la figure 3 ci-dessous, produit du dioxyde de carbone, de la vapeur d'eau et de l'énergie. L'utilisation de combustibles fossiles fournit environ 95 % de l'énergie primaire mondiale.
Vidéo
La vidéo ci-dessous vient du projet de vidéos périodiques de l'Université de Nottingham. [8] Dans cette vidéo, il s'agit de l'oxygène et également de l'ozone.
Références
- ↑ Créé en interne par un membre de l'Équipe de l'éducation en matière d'énergie, avec des informations de periodictable.com, disponible sur: http://periodictable.com/Elements/008/index.html
- ↑ Periodic Table, Abundance in the Universe [Online], Available: http://periodictable.com/Properties/A/UniverseAbundance.v.log.html
- ↑ Periodic Table, Abundance in the Ocean [Online], Available: http://periodictable.com/Properties/A/OceanAbundance.v.log.html
- ↑ Wikimedia Commons [Online], Available: http://upload.wikimedia.org/wikipedia/commons/0/0d/Iss007e10807.jpg
- ↑ Hyperphysics, Element Abundance in the Earth's Crust [Online], Available: http://hyperphysics.phy-astr.gsu.edu/hbase/tables/elabund.html
- ↑ NASA, Ozone Hole Watch: Facts about ozone [Online], Available: http://ozonewatch.gsfc.nasa.gov/facts/SH.html
- ↑ American Chemical Society. "Methane and oxygen react". Internet: http://www.middleschoolchemistry.com/multimedia/chapter6/lesson1, [October 25,2013]
- ↑ Veuillez voir plus de vidéos de l'Université de Nottingham sur différents éléments ici : http://www.periodicvideos.com/

