Smog photochimique

Le smog photochimique est un type de smog produit lorsque la lumière ultraviolette du soleil réagit avec les oxydes d'azote dans l'atmosphère. Il est visible sous la forme d'une brume brune, et est plus visible le matin et l'après-midi, en particulier dans les villes chaudes et densément peuplées.[2] Les villes qui subissent quotidiennement ce smog sont Los Angeles, Sydney, la ville de Mexico, Pékin, et bien d'autres.
Formation
Le smog photochimique se forme à partir d'un processus complexe, mais sa source est assez évidente. Les automobiles en sont la principale source, tandis que les centrales électriques au charbon et certaines autres centrales électriques produisent également les polluants nécessaires pour faciliter sa production. En raison de son abondance dans les régions où la température est plus élevée, le smog photochimique est plus fréquent en été.[3]
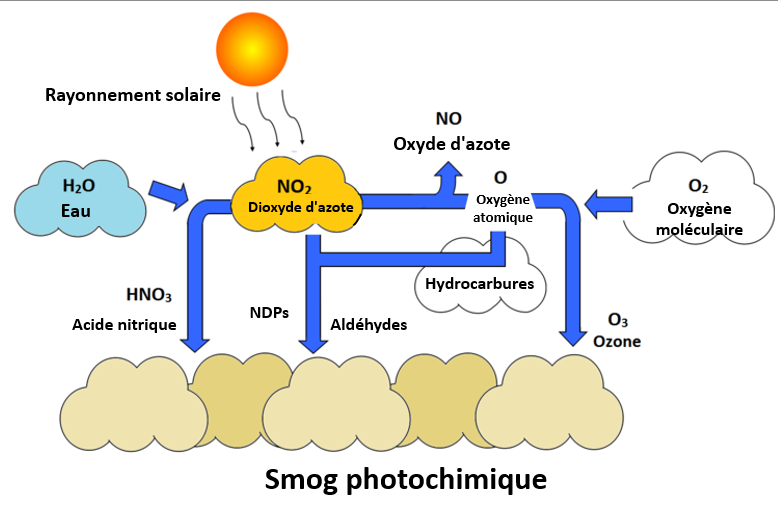
Elle se forme le matin, lorsqu'un très grand nombre de personnes conduisent leur véhicule pour se rendre au travail. Les oxydes d'azote produits dans le moteur de la voiture sont introduits dans l'atmosphère et peuvent se combiner avec l'eau pour former de l'acide nitrique ou réagir avec la lumière du soleil pour produire des atomes singuliers d'oxygène, qui se combinent ensuite avec l'oxygène moléculaire pour produire de l'ozone.[2] L'acide nitrique peut se précipiter sur la Terre et donner lieu à des pluies acides, ou rester dans le smog. En raison de sa production directe par les véhicules, le smog se forme au-dessus des villes où de nombreuses personnes peuvent être confrontées à ses effets néfastes sur la santé.
Des journées plus chaudes signifient plus de smog photochimique, en particulier dans les villes densément peuplées telles que celles mentionnées ci-dessus. Comme de plus en plus de populations urbaines apparaissent dans le monde, ce problème ne peut que s'aggraver.[4]
Composition
Le monoxyde d'azote (NO) et le dioxyde d'azote (NO2) sont émis par la combustion de combustibles fossiles, et sont également émis naturellement par des phénomènes tels que les volcans et les feux de forêt (c'est toutefois l'immense concentration de ces polluants dans les villes qui est la plus préoccupante, car les émissions naturelles ont tendance à s'étendre sur de plus grandes zones). Lorsqu'il est exposé aux rayons ultraviolets, le NO2 subit une série complexe de réactions avec les hydrocarbures pour produire les composants du smog photochimique - un mélange d'ozone, d'acide nitrique, d'aldéhydes, de nitrates de peroxyacyle (NPA) et d'autres polluants secondaires.[4]
Le NO2, l'ozone et les NPA sont appelés oxydants photochimiques parce qu'ils peuvent réagir et oxyder certains composés dans l'atmosphère ou dans les poumons d'une personne qui ne sont pas normalement oxydés. Même de petites traces de ces produits chimiques peuvent affecter les voies respiratoires des humains et des animaux, et endommager les récoltes et les arbres.[4]
Effets
Le smog photochimique a de nombreux effets néfastes. Lorsqu'ils sont combinés à des hydrocarbures, les produits chimiques qu'ils contiennent forment des molécules qui provoquent une irritation des yeux. Les radicaux présents dans l'air interfèrent avec le cycle de l'azote en empêchant la destruction de l'ozone troposphérique. Parmi les autres effets, mentionnons la réduction de la visibilité et les troubles respiratoires.[3]
De l'ozone troposphérique est également produit et a divers effets sur le corps humain. Pour plus d'informations, consultez la page ozone.
En savoir plus
- Ultraviolet
- Smog
- Atmosphère
- Polluant
- Combustion des hydrocarbures
- Ou explorez une page au hasard
Références
- ↑ Wikimedia Commons [Online], Available: https://upload.wikimedia.org/wikipedia/commons/d/d1/Shanghaiairpollutionsunset.jpg
- ↑ 2,0 et 2,1 B. Everett, G. Boyle, S. Peake and J. Ramage, "," in "Penalties: Assessing the Environmental and Health Impacts of Energy Use," in Energy Systems and Sustainability, 2nd ed., Oxford, UK: Oxford, 2013, ch.13, pp.543
- ↑ 3,0 et 3,1 R. A. Hinrichs and M. Kleinbach, "Nitrogen oxides, photochemical smog and ozone," in Energy: Its Use and the Environment, 5th ed. Toronto, Ont. Canada: Brooks/Cole, 2013, ch.8, sec.C, pp.250-252
- ↑ 4,0 4,1 et 4,2 G. Tyler Miller, Jr. and D. Hackett, "Photochemical and Industrial Smog," in Living in the Environment, 2nd ed. USA: Nelson , 2011, ch.20, sec.3, pp.465-471
- ↑ Adapted from Living In The Environment. See Reference 4.

